
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Síndrome de hiperestimulación ovárica
Médico experto del artículo.
Último revisado: 05.07.2025
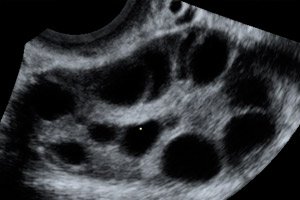
El síndrome de hiperestimulación ovárica (SHO) es una complicación iatrogénica basada en la respuesta hiperérgica no controlada de los ovarios a la administración de gonadotropinas en ciclos de estimulación de la ovulación y programas de tecnología de reproducción asistida.
El síndrome puede manifestarse después de la inducción de la ovulación con clomifeno o al inicio del embarazo en un ciclo espontáneo.
 [ 1 ]
[ 1 ]
Epidemiología
La incidencia del síndrome de hiperestimulación ovárica varía entre el 0,5 % y el 14 % con diferentes esquemas de estimulación de la ovulación y no tiende a disminuir. La enfermedad presenta distintos grados de gravedad y puede ser mortal debido al desarrollo de complicaciones tromboembólicas o SDRA. La tasa de mortalidad esperada es de 1 por cada 450 000 a 500 000 mujeres. Las formas graves del síndrome, que requieren hospitalización en la unidad de cuidados intensivos, se presentan en un 0,2-10 %. Según el Registro Nacional Ruso de Métodos de Reproducción Asistida, la incidencia de SHO grave en 2004 fue del 5,6 %.
Causas del síndrome de hiperestimulación ovárica
Factores de riesgo para desarrollar el síndrome de hiperestimulación ovárica:
- edad menor de 35 años,
- físico asténico,
- la presencia de ovarios poliquísticos o multifoliculares,
- maduración de más de diez folículos en el protocolo de estimulación de la ovulación,
- uso de fármacos agonistas de la hormona liberadora de gonadotropina y dosis altas de gonadotropinas,
- el inicio del embarazo,
- Apoyo a la fase lútea con preparaciones de hCG,
- enfermedades alérgicas.
¿Cómo se desarrolla el síndrome de hiperestimulación ovárica?
El síndrome de hiperestimulación ovárica se produce en el contexto de una concentración anormalmente alta de hormonas sexuales en el plasma sanguíneo, lo que afecta negativamente las funciones de diversos sistemas corporales, principalmente los ovarios. Se caracteriza por un aumento del tamaño de los ovarios, en ocasiones de hasta 20-25 cm de diámetro, con la formación de quistes foliculares y lúteos en ellos, en un contexto de edema estromal pronunciado. El desencadenante del síndrome es la administración de una dosis ovulatoria de gonadotropina coriónica. El desarrollo del síndrome se basa en el fenómeno de aumento de la permeabilidad vascular, que provoca una liberación masiva de líquido rico en proteínas hacia el tercer espacio intersticial y su depósito, con el desarrollo de hipovolemia, hemoconcentración, oliguria, hipoproteinemia, desequilibrio electrolítico, aumento de la actividad de las enzimas hepáticas, formación de ascitis, hidrotórax e hidropericardio, con o sin shock hipovolémico. Sin embargo, se desconoce el factor X que causa la trasudación de líquido. En casos graves, se producen anasarca, insuficiencia renal aguda, complicaciones tromboembólicas y SDRA.
Actualmente, el síndrome de hiperestimulación ovárica se considera desde la perspectiva del SIRS, en cuyo contexto se produce un daño masivo al endotelio. En pacientes con SHO, se encontraron altas concentraciones de interleucinas (IL-1, IL-2, IL-6, IL-8), factores de necrosis tumoral (TNF-a, TNF-(3)), que mejoran la síntesis de prostaglandinas por los ovarios, la neovascularización ovárica y la permeabilidad vascular, en el trasudado peritoneal. Bajo la influencia de las citocinas proinflamatorias, se produce la activación sistémica de los procesos de coagulación. La magnitud de la leucocitosis se correlaciona con la gravedad del SIRS. El daño órgano-sistémico en el SHO es similar al daño que ocurre en la sepsis. El papel del factor microbiano en el SHO y su contribución al desarrollo del SIRS está actualmente en discusión. Se supone que los microorganismos que colonizan los intestinos y el tracto genitourinario pueden penetrar más allá de su hábitat y tener un efecto en el organismo similar al que se produce en la sepsis.
Síntomas del síndrome de hiperestimulación ovárica
La gravedad del síndrome está directamente relacionada con la gravedad de los trastornos hemodinámicos que causan el cuadro clínico. Su inicio puede ser gradual, con aumento de los síntomas, o repentino (agudo), con una redistribución brusca de líquidos en el organismo en pocas horas, acumulándose en las cavidades serosas. Cuando el síndrome se manifiesta, se presentan quejas de debilidad, mareos, dolor de cabeza, sensación de "moscas" parpadeando ante los ojos, dificultad para respirar en reposo y durante el esfuerzo físico, tos seca que se intensifica al estar acostado, sequedad bucal, náuseas, vómitos, diarrea, distensión abdominal, sensación de tensión, dolor abdominal a menudo sin localización clara, micción poco frecuente, fiebre e hinchazón de los genitales externos y las extremidades inferiores.
En pacientes con síndrome de hiperestimulación ovárica, puede desarrollarse insuficiencia respiratoria debido a la movilidad pulmonar limitada por ascitis, agrandamiento ovárico o derrame pleural. El curso del SHO grave en la etapa de manifestación puede complicarse con hidrotórax agudo, SDRA, embolia pulmonar, embolia pulmonar, atelectasia y hemorragia intraalveolar. El derrame pleural se diagnostica en aproximadamente el 70% de las mujeres con SHO moderado a grave, y el derrame puede ser unilateral o bilateral y ocurre en el contexto de ascitis. En el SHO, se ha descrito el desplazamiento y la compresión de los órganos mediastínicos debido a un derrame pleural masivo del lado derecho con el desarrollo de shock, así como un desenlace fatal en una mujer con SHO e hidrotórax debido a atelectasia, hemorragia masiva en el lumen alveolar.
Trastornos hemodinámicos. En el síndrome de hiperestimulación ovárica (SHO) moderado y grave, se presentan hipotensión arterial y taquicardia.
Ascitis. El abdomen está distendido, a menudo tenso, doloroso en todas las zonas, pero con mayor frecuencia en el hipogastrio, en la proyección de los ovarios.
Disfunción renal y hepática. Se observan retención urinaria, oliguria, anuria y hepatomegalia.
El SHO se acompaña de fiebre en el 80% de las pacientes con una forma grave del síndrome. En el 20% de las mujeres, la fiebre se presenta en el contexto de una infección del tracto urinario, en el 3,8%, debido a neumonía, y en el 3,3%, a una infección del tracto respiratorio superior. La tromboflebitis, debida a la colocación de un catéter intravenoso, causa fiebre en el 2% de las pacientes, y la inflamación de la grasa subcutánea en el sitio de punción de la pared abdominal durante la laparocentesis, en el 1% de las pacientes. La infección de la herida quirúrgica se presenta en el 1%, y los abscesos postinyección (administración intramuscular de progesterona) en el 0,5%. La fiebre de génesis no infecciosa en una de cada dos pacientes con SHO probablemente se asocia con mecanismos pirogénicos endógenos. Se han descrito casos aislados de sepsis en el SHO grave.
En el contexto del desarrollo del síndrome, se produce una exacerbación de enfermedades somáticas crónicas latentes.
¿Qué te molesta?
Clasificación
No existe una clasificación única del síndrome de hiperestimulación ovárica. Según los síntomas clínicos y de laboratorio, se distinguen cuatro grados de gravedad:
- SHO leve. Molestias abdominales, ovarios de hasta 8 cm de diámetro con o sin quistes, parámetros de laboratorio normales. El SHO leve se denomina «hiperestimulación ovárica controlada», ya que se observa en absolutamente todos los ciclos de estimulación de la superovulación y actualmente no se considera un síndrome patológico que requiera tratamiento.
- SHO moderado. Dolor moderado en todo el abdomen, náuseas, vómitos, diarrea, ovarios de 8-12 cm de diámetro con quistes, signos ecográficos y/o clínicos de ascitis, hematocrito inferior al 45%, leucocitosis: 10-16 x 10⁻¹ /l, hipercoagulabilidad (dímero D: superior a 0,5 μg/ml, concentración de fibrinógeno: superior a 400 mg/dl, TTPA e INR dentro de los límites normales).
- SHO grave. Hematocrito superior al 45%, leucocitosis 17-24 x 10⁻¹ /l, hipercoagulabilidad (dímero D superior a 5 μg/ml, fibrinógeno superior a 600 mg/dl), ovarios de más de 12 cm de diámetro con quistes, todos los signos clínicos y de laboratorio de SHO moderado y ascitis a tensión, hidrotórax, disfunción hepática, oliguria (diuresis inferior a 0,5 ml/(kg·h)).
- SHO crítico. Hematocrito superior al 55%, leucocitosis superior a 25 x 109/l, ascitis a tensión, hidrotórax bilateral, hidropericardio, anasarca, ovarios aumentados de tamaño hasta 20-25 cm, oliguria o anuria, insuficiencia renal aguda, complicaciones tromboembólicas, SDRA.
El síndrome de hiperestimulación ovárica también se divide en temprano y tardío.
Si el SHO se presenta en la fase lútea y no se produce la implantación, el síndrome desaparece repentina y espontáneamente con el inicio de la menstruación, y rara vez alcanza una forma grave. Si se produce la implantación, lo más frecuente es que se observe un deterioro del estado de la paciente durante las primeras 12 semanas de embarazo. El SHO tardío se debe a un aumento significativo de la hCG en el plasma sanguíneo y suele asociarse con la implantación y el inicio del embarazo.
Consecuencias y complicaciones
Las complicaciones del síndrome de hiperestimulación ovárica pueden derivar en complicaciones tromboembólicas. La causa de la trombosis en el SHO se desconoce, pero el papel principal en la patogénesis de esta afección se atribuye a las altas concentraciones de hormonas sexuales, citocinas proinflamatorias, hemoconcentración y disminución de la PCV. Los largos periodos de hospitalización, la actividad motora limitada, la disminución del retorno venoso debido al aumento de la actividad ovárica, el aumento de la actividad de los factores de coagulación, los inhibidores de la fibrinólisis y las plaquetas contribuyen adicionalmente al alto riesgo de desarrollar complicaciones trombóticas asociadas al SHO. Se ha demostrado que en el 84% de las pacientes con complicaciones tromboembólicas que surgieron después de la inducción de la ovulación y en programas de reproducción asistida, su desarrollo se produjo durante el embarazo. En el 75% de los casos, la formación de trombos se observó en el lecho venoso, con una localización predominante en los vasos de las extremidades superiores, el cuello y la cabeza (60%). A varias pacientes se les diagnosticó trombosis arterial espontánea localizada en los vasos cerebrales. Con menor frecuencia, se observaron trombos en las arterias femoral, poplítea, carótida, subclavia, ilíaca, cubital, mesentérica y en la aorta. La literatura presenta una observación del desarrollo de oclusión de la arteria central de la retina con pérdida de visión en pacientes con SHO. La incidencia de embolia pulmonar en pacientes con SHO y trombosis venosa profunda de las extremidades inferiores es del 29%, mientras que en mujeres con SHO y trombosis venosa profunda de las extremidades superiores y trombosis arterial, el riesgo de esta complicación es significativamente menor, del 4% y el 8%, respectivamente.
Los casos graves de síndrome de hiperestimulación ovárica pueden ir acompañados de complicaciones que requieren intervención quirúrgica: ruptura de un quiste ovárico y sangrado intraabdominal, torsión de los apéndices uterinos, embarazo ectópico.
Diagnóstico del síndrome de hiperestimulación ovárica
El diagnóstico del síndrome de hiperestimulación ovárica se establece sobre la base de datos de anamnesis, un examen clínico, de laboratorio e instrumental completo que revela ovarios agrandados con múltiples quistes, hemoconcentración pronunciada e hipercoagulación en una paciente que utilizó tecnologías de reproducción asistida o inducción controlada de la ovulación en este ciclo para lograr el embarazo.
Investigación de laboratorio
Análisis de sangre clínico
Hematocrito superior al 40%, concentración de hemoglobina superior a 140 g/l, leucocitosis de hasta 50 x 10⁻¹ /l sin desviación a la izquierda, trombocitosis de hasta 500-600 x 10⁻¹ /l. Una hemoconcentración (hematocrito superior al 55%) indica un riesgo potencial de muerte.
Análisis bioquímico de sangre
Desequilibrio electrolítico, que incluye hiperpotasemia (más de 5,3 mmol/l) e hiponatremia (más de 135 mmol/l), lo que provoca una disminución de la osmolaridad plasmática. Hipoproteinemia (proteínas totales superiores a 66 g/l), hipoalbuminemia (albúmina inferior a 35 g/l), proteína C reactiva elevada, aumento de las transaminasas hepáticas hasta 800 U/l, en algunos casos, aumento de la GGT o la fosfatasa alcalina, y en algunos pacientes, aumento de la concentración de creatinina superior a 80 μmol/l y de la urea superior a 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Coagulograma
Aumento de los niveles de fibrinógeno por encima de 400 mg/dl, factor de von Willebrand por encima del 140 %, disminución de las concentraciones de antitrombina III por debajo del 80 %, dímero D por encima de 0,5 mcg/ml. Valores normales de TTPA, ITP e INR.
 [ 24 ]
[ 24 ]
Inmunoglobulinas sanguíneas
Disminución de la concentración plasmática de IgG e IgA. Análisis general de orina. Proteinuria.
Análisis de la composición del líquido ascítico
Alto contenido de proteínas (más de 42 g/l) y albúmina (más de 23 g/l), bajo recuento de glóbulos blancos, recuento relativamente alto de glóbulos rojos, altas concentraciones de todas las citocinas proinflamatorias, proteína C reactiva hasta 135 mg/l (normal 0-8,2 mg/l), fracción de globulina de proteínas.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Marcadores tumorales en el plasma sanguíneo
La concentración de CA-125, que refleja la proliferación masiva del tejido ovárico, alcanza sus valores máximos (hasta 5125 U/ml) hacia la segunda semana de desarrollo del SHO, cuando ambos ovarios presentan su máximo crecimiento. El nivel elevado del marcador tumoral persiste hasta 15-23 semanas después de la aparición de signos de síndrome de hiperestimulación ovárica, a pesar del tratamiento.
La procalcitonina en el suero sanguíneo se determina en el 50% de los pacientes en el rango de 0,5-2,0 ng/ml, lo que se considera una reacción inflamatoria sistémica moderada.
Investigación microbiológica
Al examinar la orina secretada por la vagina y el canal cervical, se aíslan patógenos atípicos Pseudomonas, Proteus, Klebsiella, Enterobacter, E. coli en cantidades de más de 10.000 UFC/ml.
Investigación instrumental
Ecografía de los órganos pélvicos
Ovarios agrandados de 6 a 25 cm de diámetro con múltiples quistes, útero de tamaño normal o agrandado, presencia de líquido libre en la cavidad pélvica y embarazo único o múltiple progresivo normal.
Ecografía de los órganos abdominales
Presencia de líquido libre en la cavidad abdominal en una cantidad de 1 a 5-6 litros. Tamaño y estructura hepática normales o hepatomegalia. Signos ecográficos de discinesia biliar. Al examinar los riñones, el complejo calicial-pélvico permanece inalterado.
Ecografía de las cavidades pleurales
Presencia de líquido libre en la ecocardiografía. En el contexto de alteraciones hemodinámicas, se observó disminución de la FE, disminución del volumen telediastólico, disminución del retorno venoso y, en algunos casos, presencia de líquido libre en la cavidad pericárdica.
ECG
Alteración del ritmo, como extrasístole ventricular, taquicardia, cambios metabólicos y electrolíticos difusos en el miocardio. Radiografía de tórax. Se realiza si se sospecha SDRA y tromboembolia. Un hallazgo radiográfico característico en el SDRA es la aparición de un patrón en "vidrio esmerilado" e infiltrados multifocales difusos de densidad relativamente alta (consolidación) con bronquios aéreos bien definidos, es decir, el desarrollo de un daño extenso en el parénquima pulmonar. En la embolia pulmonar, la radiografía revela una posición elevada de la cúpula diafragmática, atelectasia discoide, plétora de una de las raíces pulmonares o una raíz "cortada", depleción del patrón pulmonar sobre el área isquémica del pulmón y una sombra triangular periférica de inflamación.
Indicaciones de consulta con otros especialistas
Debido a la participación de todos los órganos y sistemas en el proceso patológico, es imprescindible la evaluación por parte de un terapeuta. Si se sospechan complicaciones trombóticas, se requiere una consulta con un cirujano vascular. En caso de hidrotórax pronunciado, se requiere una consulta con un cirujano torácico para decidir si se realiza una punción pleural.
¿Qué es necesario examinar?
Cómo examinar?
¿Qué pruebas son necesarias?
Tratamiento del síndrome de hiperestimulación ovárica
La ausencia de un concepto claro de la fisiopatología del SHO imposibilita llevar a cabo un tratamiento eficaz y patogenéticamente fundamentado que permita detener de forma eficaz y rápida el desarrollo del síndrome y los trastornos multiorgánicos que acompañan a las formas graves del síndrome de hiperestimulación ovárica. Actualmente, no existe una terapia específica para el síndrome de hiperestimulación ovárica, por lo que las medidas de tratamiento para estas pacientes se reducen a la terapia patogenética hasta la regresión espontánea del síndrome a medida que la concentración de hCG en el plasma sanguíneo disminuye durante 7 días en ciclos donde no se ha producido el embarazo, o 10-20 días cuando sí se ha producido el embarazo. La mayoría de las pacientes hospitalizadas en unidades de cuidados intensivos ya ingresan con un diagnóstico de SHO después del tratamiento ambulatorio, que consiste en la evaluación diaria del peso y la diuresis, la limitación de la actividad física excesiva y la actividad sexual, el consumo abundante de alcohol con la adición de soluciones ricas en electrolitos y análisis de sangre periódicos. La discusión de la estrategia de tratamiento para este grupo de pacientes involucra un tratamiento sintomático integral dirigido a prevenir el desarrollo de FRP mediante la restauración del PCC, eliminar la hemoconcentración, el desequilibrio electrolítico, prevenir la insuficiencia renal aguda, el SDRA y las complicaciones tromboembólicas.
Etapa 1: evaluación de la gravedad de la afección
El primer paso para determinar las tácticas de manejo de una paciente con síndrome de hiperestimulación ovárica es evaluar la hemodinámica y la función respiratoria. También es necesario realizar una exploración física completa con un estudio exhaustivo del estado de las extremidades, la cabeza y el cuello para descartar una trombosis venosa profunda e instalar un catéter venoso periférico o una cateterización venosa central. La cateterización de la vena subclavia es la más adecuada, ya que el riesgo de trombosis en este caso es mínimo. El cateterismo vesical es necesario para evaluar la diuresis. Es necesario examinar diariamente los parámetros analíticos clínicos, los electrolitos plasmáticos, las proteínas, la actividad de las enzimas hepáticas, la creatinina, los niveles de urea y los parámetros del coagulograma. Se realiza una ecografía abdominal para determinar el grado de agrandamiento ovárico y la presencia de ascitis.
Etapa 2 - terapia de infusión
El tratamiento farmacológico de las pacientes con SHO debe centrarse en mantener la hemodinámica y movilizar el líquido contenido en la cavidad abdominal mediante la creación de un balance negativo de sodio y agua. El objetivo principal es reponer el volumen de líquido circulante para reducir la hemoconcentración y mantener una filtración renal adecuada. Las soluciones cristaloides y coloides se utilizan para la terapia de infusión del síndrome de hiperestimulación ovárica.
La elección de la solución cristaloide depende del desequilibrio electrolítico. Al determinar la cantidad de cristaloides administrados, es necesario tener en cuenta que, en caso de daño endotelial generalizado, el volumen de estas soluciones debe ser de 2 a 3 veces menor que el de las soluciones coloides, ya que el predominio de cristaloides agrava la acumulación de líquido en las cavidades serosas y, en algunos casos, conduce al desarrollo de anasarca.
El fármaco de elección para la restauración y el mantenimiento del volumen intravascular en pacientes con SHO es el hidroxietil almidón 130/0 42, con un volumen diario de 25-30 ml/kg. El hidroxietil almidón 200/0 5 también puede utilizarse en el tratamiento básico del SHO en un volumen de 20 ml/(kg x día). Sin embargo, puede acumularse en el organismo y, con el uso prolongado, causar disfunción hepática y aumentar el nivel de transaminasas hepáticas, en ocasiones hasta 800 U/l. En este grupo de pacientes, no es apropiado utilizar hidroxietil almidón 450/0 7 debido al alto riesgo de reacciones alérgicas, el impacto negativo en la función renal y hepática, y el deterioro de los parámetros de hemocoagulación (prolongación del tiempo de coagulación sanguínea, riesgo de complicaciones hemorrágicas). Las indicaciones para el uso de soluciones de dextrano están limitadas por la alta frecuencia de reacciones alérgicas, el impacto negativo en el sistema de hemostasia, la liberación del factor de von Willebrand, la inducción de la cascada proinflamatoria y la falta de impacto en las propiedades reológicas de la sangre en las dosis utilizadas. La infusión de dextranos en condiciones de aumento de la permeabilidad capilar puede provocar el desarrollo del llamado síndrome de dextrano, acompañado de OL, deterioro de la función hepática y renal, y el desarrollo de coagulopatía. Las soluciones de gelatina tampoco están indicadas para la terapia de infusión en el SHO.
Con una hipoproteinemia inferior a 25 g/l, se utiliza una solución de albúmina al 20%, con un volumen diario de 3 ml/kg. Se recomienda utilizar únicamente una solución de albúmina al 20%, ya que la presión oncótica de una solución al 20% es de aproximadamente 100 mmHg, y la de una solución al 5% es de aproximadamente 20 mmHg. En condiciones de alta permeabilidad del endotelio vascular, la infusión de una solución de albúmina al 5%, a diferencia de una solución al 20%, produce un intercambio más intenso con el fondo extravascular y un aumento brusco de la presión oncótica en el intersticio, lo que a su vez provoca un aumento de la hiperhidratación intersticial pulmonar.
Los diuréticos están justificados en caso de oliguria y edema periférico, con hematocritos del 36-38 %. La prescripción prematura o excesiva de diuréticos puede agravar la hipovolemia y la hemoconcentración, aumentando así el riesgo de complicaciones trombóticas. Se utiliza principalmente furosemida: 20-40 mg una vez por vía intramuscular o intravenosa lenta durante 1-2 minutos.
Principios de la terapia de infusión para el síndrome de hiperestimulación ovárica
Después de administrar la dosis inicial de soluciones cristaloides y coloides, el volumen de la terapia de infusión adicional se determina teniendo en cuenta los siguientes parámetros: diuresis: menos de 1 ml/(kg h), hematocrito menos de - 40%, presión arterial media: más de 70 mm Hg, presión venosa central: 8-10 mm H2O. Cuando se alcanzan los parámetros especificados, se detiene la terapia de infusión. Es aconsejable administrar el volumen diario total de soluciones de infusión en fracciones a lo largo del día. El incumplimiento de estos enfoques da como resultado el desarrollo de hemodilución, que provoca una rápida acumulación de líquido en las cavidades serosas y el deterioro de la condición del paciente. Un error típico en el tratamiento de mujeres con SHO es la prolongación injustificada de la terapia de infusión cuando los parámetros hemodinámicos se han normalizado y un intento de detener completamente el desarrollo del SHO como una condición iatrogénica.
Etapa 3 - prevención de complicaciones
Prevención de la trombosis y tromboembolia
La base para prevenir las complicaciones trombóticas en el síndrome de hiperestimulación ovárica es la eliminación de la hemoconcentración. El tratamiento antitrombótico está indicado cuando aparecen signos de hipercoagulabilidad en las pruebas de laboratorio. La HBPM se utiliza para esto:
- nadroparina cálcica (dosis diaria: 100 UI anti-Xa/kg 2 veces por vía subcutánea),
- dalteparina sódica (100-150 UI anti-Xa/kg 2 veces por vía subcutánea),
- enoxaparina sódica (1 ml/kg/día) 1-2 veces por vía subcutánea).
Monitoreo de laboratorio: determinación de la actividad anti-Xa plasmática 3 horas después de la administración de HBPM, lo que permite mantener una dosis efectiva del fármaco dentro del rango terapéutico seguro y, por lo tanto, minimizar la probabilidad de sangrado. Se continúa con el tratamiento antitrombótico hasta que se normalicen los parámetros de coagulación sanguínea. El monitoreo se realiza mediante la determinación de la concentración plasmática de dímero D mediante un método cuantitativo. La duración de la administración de HBPM se determina individualmente y, en algunos casos, puede superar los 30 días.
Prevención de complicaciones infecciosas
Teniendo en cuenta el efecto positivo de la prescripción de preparaciones de inmunoglobulina en la prevención de infecciones secundarias en otras enfermedades con pérdida de proteínas, se puede esperar la eficacia de esta terapia en pacientes con SHO. Sin embargo, para la confirmación o refutación definitiva de esta hipótesis desde el punto de vista de la medicina basada en la evidencia, es necesario realizar estudios. Actualmente, la indicación para la terapia antibacteriana empírica es el riesgo de infección secundaria en pacientes en estado crítico o con hemodinámica inestable. El fármaco seleccionado empíricamente se modifica en función de los resultados de las pruebas bacteriológicas. Al prescribir la terapia antibacteriana empírica, es necesario guiarse por la información sobre la gravedad de la enfermedad, los factores de riesgo de infección y las características de la resistencia a los antibióticos en una UCI determinada.
Apoyo nutricional
Se administra por vía oral a todos los pacientes con SHO grave y crítico. Es necesario seguir las siguientes recomendaciones:
- valor energético 25-35 kcal/(kgxdía),
- glucosa - menos de 6 g/(kg x día),
- lípidos - 0,5-1 g/(kg x día),
- proteínas - 1,2-2 g/(kg x día),
- Conjunto diario estándar de microelementos y vitaminas.
Etapa 4 - métodos quirúrgicos
Indicaciones de laparocentesis en mujeres con síndrome de hiperestimulación ovárica:
- ascitis tensa progresiva,
- oliguria inferior a 0,5 ml/dkg/min),
- un aumento de la concentración de creatinina por encima de 80 μmol/l o una disminución de su aclaramiento,
- hemoconcentración con un valor de hematocrito superior al 40%, no susceptible de corrección farmacológica.
Se puede optar por acceso transabdominal o transvaginal para la laparocentesis. El aumento de tamaño de los ovarios presenta dificultades técnicas, por lo que el control ecográfico es fundamental. El drenaje a largo plazo de la cavidad abdominal (laparocentesis transabdominal) de 14 a 30 días con extracción por partes del trasudado peritoneal mediante el catéter apirógeno cytoFix® ofrece diversas ventajas, ya que permite evitar la evacuación única de un gran volumen de trasudado peritoneal y, por lo tanto, eliminar las fluctuaciones bruscas de la presión intraabdominal que causan trastornos hemodinámicos, estabilizar la condición de la paciente y evitar punciones repetidas de la cavidad abdominal para extraer líquido ascítico en esta categoría de pacientes. El volumen total de líquido ascítico evacuado durante el tratamiento del SHO grave puede oscilar entre 30 y 90 litros.
En pacientes con hidrotórax y síndrome de hiperestimulación ovárica, se justifica una actitud expectante. Cuando se forma hidrotórax, la punción de la cavidad pleural solo se realiza en caso de insuficiencia respiratoria progresiva grave.
Criterios para el inicio del soporte respiratorio en el síndrome de hiperestimulación ovárica grave y crítico:
- Falta de respiración espontánea y ritmos respiratorios patológicos,
- disminución del índice respiratorio a menos de 200 mmHg,
- arritmias cardíacas potencialmente mortales,
- taquicardia persistente superior a 120,
- hipotensión severa,
- taquipnea mayor de 40,
- afectación de los músculos respiratorios accesorios.
En caso de desarrollo de SDRA y transferencia a ventilación mecánica se utiliza lo siguiente:
- pequeños volúmenes respiratorios (6 ml/kg),
- presión inspiratoria <30 cm H2O,
- PEEP (>10 cm H2O),
- Se utiliza la maniobra de reclutamiento alveolar.
El tratamiento quirúrgico del síndrome de hiperestimulación ovárica solo se justifica en presencia de patología aguda como torsión del apéndice ovárico, rotura del quiste ovárico o hemorragia del mismo. En caso de torsión ovárica, la destorsión ovárica laparoscópica es la más eficaz. Un error típico en la estrategia terapéutica para pacientes con SHO sin complicaciones es la cirugía de urgencia y la resección de aproximadamente el 30-50% del tejido ovárico, o la ooforectomía bilateral.

