
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Medicamentos que previenen la trombosis y mejoran la reología sanguínea
Médico experto del artículo.
Último revisado: 07.07.2025
En la prevención de la formación de múltiples microtrombos durante el shock y su destrucción, se pueden utilizar diversos enfoques farmacológicos que utilizan fármacos que previenen la formación de trombos y mejoran la reología sanguínea:
- eliminación de trastornos hemodinámicos y de la microcirculación sistémica mediante agentes vasoactivos e inotrópicos;
- medidas para mejorar la reología sanguínea mediante una terapia de infusión racional y medicamentos que restablecen la elasticidad de las membranas de los eritrocitos (trental o pentoxifilina);
- prevención de la agregación plaquetaria y la formación de trombos “blancos” iniciales en vasos arteriales pequeños con posterior inicio de la cascada de coagulación;
- inhibición de la formación de trombos después de la activación de la cascada de coagulación sistémica;
- activación de la fibrinólisis con el objetivo de disolver los coágulos sanguíneos neoformados (fibrinolisina, estreptoquinasa, estreptodecasa, uroquinasa, etc.) o, por el contrario, inhibición de la fibrinólisis cuando es generalizada en algunos pacientes con shock traumático y sepsis (ácido aminocaproico, amben, contrical, etc.).
La mayoría de los enfoques mencionados son tradicionales, están bien desarrollados en la práctica del tratamiento del shock, tienen sus propias indicaciones hemorreológicas y se especifican en los capítulos correspondientes. Por lo tanto, en esta sección es recomendable analizar el enfoque general para la prevención de la formación de trombos en el shock mediante agentes farmacológicos que afectan la profase de la coagulación sanguínea. Es este nivel de prevención de las complicaciones de la coagulación (la aparición, formación y crecimiento de trombos arteriales blancos) el que mayor interés despierta entre los investigadores.
Diversos trastornos, a menudo multidireccionales, de la coagulación sanguínea con deterioro de su reología son característicos de los diferentes tipos de shock. El más característico de los shocks séptico, endotóxico, por quemaduras, traumático y hemorrágico es la formación de múltiples microtrombos en los vasos más pequeños, causada por trastornos de la hemodinámica sistémica, vasoespasmo y trastornos de la microcirculación, espesamiento de la sangre, sedimentación, disminución de la elasticidad de las membranas eritrocitarias, así como numerosos factores generales y locales (autocoides) que inician cambios locales en la hemostasia de la coagulación y la inclusión de la profase de la coagulación sanguínea.
De forma esquemática (abreviada) se presenta a continuación la etapa inicial de la hemocoagulación y el mecanismo de la homeostasis de la hemocoagulación local.
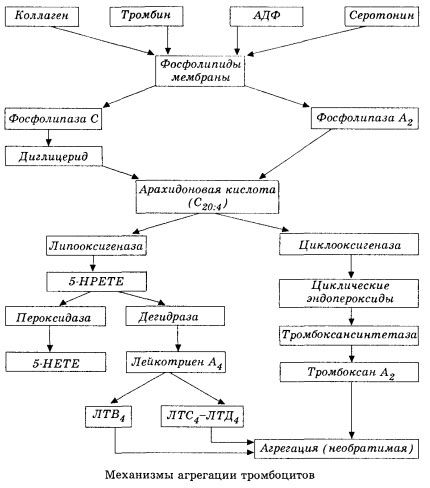
Comienza con la activación de la fosfolipasa A2 de membrana como resultado del impacto de una combinación de factores dañinos (daño directo a la membrana, hipoxia, peroxidación lipídica, impacto de factores químicos endógenos, etc.). Como resultado de la degradación de los fosfolípidos de membrana, se liberan ácidos grasos de cadena larga no esterificados, de los cuales el ácido araquidónico es el más importante como sustrato inicial. Su transformación (cascada del ácido araquidónico) ocurre a través de las vías de la lipoxigenasa (síntesis de leucotrienos) y la ciclooxigenasa (síntesis de prostaglandinas, tromboxanos y prostaciclina).
Los leucotrienos resultantes (B4, C4, E4, D4, etc.), sustancias con una actividad biológica extremadamente alta, entre las que se incluye la sustancia de reacción lenta de la anafilaxia, son de gran importancia en el inicio de reacciones vasculares, inflamatorias e inmunitarias locales, incluyendo procesos autoinmunes. Los leucotrienos causan trastornos de la microcirculación, aumento de la coagulación sanguínea, liberación de enzimas lisosomales autolíticas y la liberación en la sangre de un factor que inhibe la contractilidad miocárdica y el espasmo bronquial.
Debido a su capacidad de provocar la contracción del músculo liso, los leucotrienos afectan significativamente la hemodinámica sistémica, los vasos coronarios y el miocardio, ejerciendo un potente efecto constrictor coronario e inotrópico negativo, que se acompaña de una disminución del gasto cardíaco y juega un papel importante en el desarrollo de hipotensión.
La reducción del gasto cardíaco y la respuesta hipotensiva a los leucotrienos se asocian con el debilitamiento del músculo cardíaco y la limitación del retorno venoso al corazón. La capacidad de los leucotrienos para aumentar la permeabilidad de la pared vascular y provocar extravasación plasmática es fundamental para limitar el retorno venoso. Se considera que los leucotrienos son importantes en la patogénesis del infarto de miocardio.
En el shock anafiláctico y séptico (por endotoxinas), su papel parece ser aún mayor, como lo demuestra la capacidad de los leucotrienos de acumularse en cantidades significativas en el plasma durante las reacciones alérgicas y de causar cambios en el flujo sanguíneo sistémico característicos del shock anafiláctico, así como los efectos protectores de los bloqueadores de los receptores de leucotrienos y los inhibidores de la lipoxigenasa. El desarrollo de bloqueadores selectivos de los receptores de leucotrienos se está llevando a cabo de forma intensiva y constituye una línea de investigación prometedora. En este ámbito, ya se han logrado ciertos avances y se ha confirmado experimentalmente la eficacia de dichos bloqueadores en la isquemia miocárdica, el shock por endotoxinas y el shock hemorrágico. Sin embargo, es probable que transcurran varios años antes de que esta línea se implemente clínicamente.
Si en los vasos venosos se forman trombos con igual participación de trombocitos y factores de coagulación plasmáticos, en las arterias los trombocitos son los principales iniciadores del proceso. Contienen ADP, Ca₂₂, serotonina, fosfolípidos, enzimas que sintetizan prostaglandinas y tromboxanos, trombostenina (que, al igual que la actomiosina muscular, proporciona la capacidad contráctil de estas células), factor de crecimiento trombogénico del epitelio y las células musculares de la pared vascular, y otras sustancias. La regulación humoral de las funciones de los trombocitos se lleva a cabo mediante receptores especializados en sus membranas (adrenorreceptores alfa₂ y beta₂, receptores de histamina y serotonina, acetilcolina, tromboxano, adenosina y otros). Una propiedad especial de los trombocitos es su alta afinidad por el colágeno y otros elementos subendoteliales de la pared vascular, así como por superficies no humectantes y con carga negativa. Esta propiedad proporciona a los trombocitos una capacidad excepcional para adherirse a una sección de un vaso con endotelio dañado, que tiene amplias posibilidades de dañarse durante el shock. En este caso, los trombocitos se dispersan y liberan pseudópodos, que pueden adherirse entre sí y a la pared vascular. La permeabilidad de la membrana aumenta y el ADP, la serotonina, el tromboxano y algunos factores de coagulación adsorbidos en la superficie del trombocito se liberan de este. Estas sustancias interactúan con los receptores correspondientes en la membrana y, con la participación de los iones de calcio, causan agregación (inicialmente reversible). El proceso se autosuficiente, lo cual es facilitado por factores reguladores humorales; otros factores, por el contrario, pueden detenerlo e incluso revertirlo, causando la desagregación.
Con el predominio de influencias y condiciones formadoras de trombos, las fases de adhesión y agregación reversible son reemplazadas por la tercera fase, la agregación irreversible, que se lleva a cabo con la participación de la trombostenina y conduce a la constricción del coágulo; la reacción de fortalecimiento del agregante y constricción también ocurre con la participación de Ca +, ATP y conduce a la formación de un trombo blanco.
La vía de la ciclooxigenasa para la conversión del ácido araquidónico en plaquetas, células endoteliales vasculares y otros tejidos asegura la homeostasis local de la coagulación (la vida media de los metabolitos es muy corta), ya que durante este metabolismo se forman potentes sustancias proagregantes y antiagregantes. El principal factor que activa la agregación plaquetaria en la cadena de reacciones de la ciclooxigenasa es el tromboxano A2, y su antagonista no menos potente es la prostaciclina, producida por las células endoteliales, y, en menor medida, las prostaglandinas de las series E y G. Finalmente, la agregación plaquetaria se ve fuertemente influenciada por otros factores humorales locales y sistémicos.
Activadores e inhibidores de la agregación plaquetaria
Iniciadores y activadores de la agregación plaquetaria |
Inhibidores de la agregación plaquetaria |
Colágeno |
- |
ADP |
Adenosina y sus estabilizadores |
Noradrenalina (a través de los receptores alfa2) |
Agentes bloqueadores alfa-adrenérgicos |
Serotonina |
Agentes antiserotoninérgicos |
Histamina |
Antihistamínicos |
Trombina |
Heparina |
Ca2+ |
Antagonistas del Ca2+ |
CGMP - sus inductores (¿acetilcolina?) y estabilizadores |
CAM - sus inductores (a través de los receptores beta-adrenérgicos) y estabilizadores (inhibidores de la fosfodiesterasa) |
Ácido araquidónico |
Dextranos, albúmina |
Tromboxano A2 |
Prostaciclina I2 |
Las intervenciones farmacológicas en la fase inicial de formación de trombos en el shock y los procesos isquémicos agudos en el corazón y el cerebro sugieren la siguiente posibilidad:
- inhibición de las reacciones iniciales (totales y parciales) de la cascada del ácido araquidónico;
- inhibición de una reacción particular de la síntesis de tromboxano;
- bloqueo de los receptores de leucotrienos y tromboxanos en plaquetas, músculo liso y otras células;
- el uso de sustancias que modulan la agregación plaquetaria, es decir, debilitan de otras maneras la reacción de ésta a la influencia de los factores iniciadores (colágeno, tromboxano A2, leucotrienos, etc.).
La implementación de las medidas mencionadas para corregir los trastornos de las propiedades reológicas de la sangre permite resolver el principal problema táctico: proteger los receptores de agregación y adhesión plaquetaria del efecto de los activadores o suprimir los mecanismos intracelulares de síntesis de estos receptores. La inhibición de las reacciones iniciales de la cascada del ácido araquidónico puede lograrse mediante la protección de los receptores plaquetarios que reaccionan a los activadores poliméricos, utilizando dextranos de bajo peso molecular, cuyas moléculas compiten con la fibrina, el colágeno, la inmunoglobulina (IgE) agregada y los componentes del sistema del complemento.
Al enmascarar los receptores en la membrana plaquetaria y competir con las proteínas de gran dispersión en la superficie de los eritrocitos, los dextranos de bajo peso molecular los desplazan y destruyen los puentes intercelulares. Esto se debe a que los dextranos, que envuelven el endotelio vascular y la superficie de los elementos celulares sanguíneos, aumentan su carga negativa, potenciando así sus propiedades antiagregantes.
Dextranos
Los dextranos de bajo peso molecular reducen la agregación plaquetaria inducida por colágeno y ADP, así como el efecto activador de la trombina sobre las plaquetas, inhiben el crecimiento del trombo plaquetario blanco inicial, mejoran el flujo sanguíneo, reducen el aumento posoperatorio del contenido de fibrinógeno plasmático y cambian la estructura y estabilidad de la fibrina.
Las infusiones intravenosas de dextranos en traumatismos y shock no solo reducen la agregación y la adhesión plaquetaria, sino que también movilizan la heparina endógena, promoviendo así la formación de un coágulo sanguíneo laxo y poco retráctil, fácilmente lisable por los fibrinolíticos. La actividad antitrombina de los dextranos de bajo peso molecular se asocia a su efecto específico sobre la estructura y la función del factor VIII de la coagulación sanguínea. El factor VIII (globulina antihemofílica), una molécula grande con una estructura y función complejas, participa en la agregación plaquetaria y la estabilidad del coágulo resultante. Los dextranos interfieren con la acción del factor VIII, ralentizando así la agregación plaquetaria y reduciendo la estabilidad del coágulo.
Los dextranos de bajo peso molecular no son verdaderos anticoagulantes y su efecto corrector en los trastornos hemorreológicos se asocia principalmente a la hemodilución, la reposición del volumen plasmático circulante y la mejora del flujo sanguíneo en el sistema de microcirculación.
La capacidad de los dextranos para mejorar el flujo sanguíneo en trastornos hemodinámicos (shock, pérdida de sangre) se debe a un conjunto de factores. La alta concentración transitoria del polímero en la sangre no solo provoca hemodilución directa, sino que también crea las condiciones para el flujo de líquido al torrente sanguíneo desde el espacio intersticial y el consiguiente equilibrio del efecto osmótico del dextrano. Como consecuencia de la hemodilución, disminuye la viscosidad sanguínea, aumenta el flujo venoso al corazón y el gasto cardíaco. Además de estos efectos, los dextranos forman complejos con el fibrinógeno y tienen un efecto antilipémico.
Por lo tanto, la acción antiagregante y los efectos hemodinámicos de los dextranos de bajo peso molecular ayudan a reducir la viscosidad sanguínea, lo cual es especialmente importante a bajas tasas de cizallamiento. La desagregación de las células sanguíneas mejora el flujo sanguíneo sistémico y la microcirculación, especialmente en su porción venosa, donde los gradientes de velocidad son mínimos. El uso de soluciones de dextrano de bajo peso molecular en diversos tipos de shock, durante el tratamiento quirúrgico de lesiones y sus consecuencias, y posteriormente en el postoperatorio, ayuda a prevenir la hipercoagulabilidad y a reducir la probabilidad de procesos trombóticos y embolias.
Sin embargo, cabe señalar que, en algunos casos, las infusiones de soluciones de dextrano se acompañan de reacciones anafilácticas y alérgicas (peligrosas en caso de sensibilización y shock anafiláctico). Esto se debe a que los dextranos, con un alto peso molecular y numerosas cadenas laterales, pueden actuar como antígeno. Por lo tanto, para determinar la sensibilidad individual, se recomienda preadministrar por vía intravenosa hasta 20 ml de una solución de dextrano de bajo peso molecular como hapteno (solución al 15 %, peso molecular 1000) y realizar infusiones de un sustituto plasmático antes de la administración de la anestesia.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibidores de la trombina
La protección farmacológica de los receptores plaquetarios que interactúan con los activadores plaquetarios también puede lograrse mediante agentes que compiten con los activadores plaquetarios no poliméricos o los inhiben. Entre estos agentes se incluyen los inhibidores de la trombina (heparina e hirudina, diversos inhibidores sintéticos, antagonistas de la adrenalina), los bloqueadores de los receptores alfa (fentolamina, dihidroergotamina), los antagonistas del ADP (dipiridamol, adenosina y sus análogos estructurales, la fosfocreatina) y los antagonistas de la serotonina (metisergida). Solo algunos de los agentes mencionados se utilizan actualmente para la prevención y el tratamiento del shock de diversos orígenes.
La protección de los mecanismos intracelulares de síntesis de receptores proteicos que reaccionan con activadores de la agregación y adhesión plaquetaria, y la inhibición de los procesos de síntesis de tromboxano son posibles con fármacos de varios grupos:
- inductores y estabilizadores de cATP, prostaciclina y prostaglandina PgE2;
- inhibidores de la fosfolipasa y la fosfodiesterasa.
El desarrollo intensivo de agentes antiplaquetarios especiales comenzó hace relativamente poco tiempo y aún no ha arrojado resultados fiables. Actualmente, en la práctica clínica, además de las soluciones de dextrano, se utilizan ampliamente agentes antiplaquetarios como el ácido acetilsalicílico, la indometacina, el dipiradamol, la sulfinpirazona (persantina), la prostaciclina (eicoprostenona) y la heparina para prevenir la formación de trombos plaquetarios blancos.
Medicamentos antiinflamatorios no esteroides
Se ha establecido que los efectos farmacológicos de los antiinflamatorios no esteroideos (ácido acetilsalicílico e indometacina) se deben a su efecto sobre el metabolismo de los eicosanoides (tromboxanos y prostaglandinas). Casi todos los fármacos de este grupo inhiben el complejo enzimático conocido como prostaglandina sintetasa, ejerciendo así sus efectos específicos y antiagregantes.
El ácido acetilsalicílico se absorbe muy rápidamente tras la administración oral. El producto de su hidrólisis, el ácido salicílico, inhibe la ciclooxigenasa plaquetaria, lo que altera la conversión del ácido araquidónico en prostaglandina O₂ y, finalmente, en tromboxano A₂. El ácido acetilsalicílico inhibe la agregación inducida por colágeno, ADP, adrenalina y serotonina. Aunque su GG0₃ es de 15 minutos, el efecto antiagregante dura varios días, lo que aparentemente se explica por la inhibición irreversible de las reacciones de síntesis de prostaglandinas y la supresión de la función de agregación plaquetaria a lo largo de toda su vida (6-10 días). Junto con la inhibición de la ciclooxigenasa plaquetaria, el ácido acetilsalicílico en dosis altas inhibe la ciclooxigenasa de la pared vascular y, simultáneamente con la supresión de la síntesis de tromboxano A₂, inhibe la síntesis de prostaciclina en las células endoteliales. Por lo tanto, se debe prescribir ácido acetilsalicílico como antiagregante en pequeñas dosis (3000-5000 mg/día), que inhiben predominantemente la agregación plaquetaria.
Considerando que el ácido acetilsalicílico bloquea la ciclooxigenasa plaquetaria durante varios días, y la ciclooxigenasa endotelial, no más de un día, es lógico prescribir el fármaco no diariamente, sino cada 3-4 días. La dosis óptima de ácido acetilsalicílico para cada paciente debe seleccionarse individualmente, ya que la sensibilidad de cada paciente al efecto antiplaquetario varía. En pacientes reactivos, el ácido acetilsalicílico a una dosis de 0,5 g inhibe la agregación plaquetaria en un 40-50%, en pacientes hiperreactivos, completamente o en un 80-90%, y en pacientes arreactivos, la ausencia de efecto antiplaquetario es característica al tomar la misma dosis del fármaco.
Los inhibidores selectivos de la tromboxano sintetasa son el imidazol y sus análogos, que no bloquean la ciclooxigenasa. El dipiridamol, utilizado en la práctica clínica para el tratamiento de la cardiopatía isquémica crónica como dilatador coronario, al igual que el imidazol, inhibe selectivamente la tromboxano sintetasa, impidiendo la síntesis de tromboxano A2. Se cree que el fármaco y sus análogos también inhiben la fosfodiesterasa plaquetaria, aumentando así la concentración de AMPc en las plaquetas. Además, el dipiridamol inhibe la actividad de la adenosina desaminasa y la captación de adenosina por las plaquetas, bloqueando la absorción de serotonina por las plaquetas y su agregación inducida por la adrenalina y el colágeno. Se ha descrito una actividad antiplaquetaria débil del fármaco y su capacidad, en pequeñas dosis, para aumentar la agregación plaquetaria. El efecto antiplaquetario más fiable se puede lograr con una combinación de dipiridamol y ácido acetilsalicílico.
Heparina
Entre los agentes antitrombóticos, uno de los reguladores más eficaces del estado de agregación sanguínea es la heparina, especialmente cuando se usa de forma precoz. La heparina posee una alta carga negativa y es capaz de interactuar con iones y moléculas grandes y pequeñas (enzimas, hormonas, aminas biógenas, proteínas plasmáticas, etc.), por lo que su espectro de acción biológica es bastante amplio. El fármaco posee efectos antitrombina, antitromboplastina y antiprotrombina, previene la conversión de fibrinógeno en fibrina, suprime la retracción del coágulo y aumenta la fibrinólisis.
El mecanismo de acción anticoagulante de la heparina es bastante complejo. Se ha establecido que sus efectos anticoagulantes se asocian con la potenciación de la acción de la antitrombina III y el aumento de la capacidad del complejo heparina-antitrombina III para inactivar rápidamente la mayoría de las serina proteasas del sistema de coagulación sanguínea. En el efecto antitrombótico de la heparina, es fundamental su capacidad para aumentar y mantener un alto potencial electronegativo de la íntima vascular, previniendo la adhesión plaquetaria y la formación de microtrombos plaquetarios. La heparina suprime de forma muy activa la formación de trombos en las venas, previniendo tanto la formación de trombos locales como la coagulación intravascular diseminada.
Prostaciclina y sus análogos estables
Entre los antiagregantes plaquetarios, los inhibidores de agregación plaquetarios más potentes son la prostaciclina y sus análogos estables. El efecto antiagregante plaquetario de la prostaciclina se debe a la estimulación de la adenilato ciclasa y, como consecuencia, a un aumento de la concentración de AMPc en las plaquetas, una disminución del contenido de tromboxano, una disminución del contenido de tromboxano A2 y el bloqueo de sus receptores. La prostaciclina es inestable y se hidroliza rápidamente a productos inactivos, por lo que se administra por vía intravenosa mediante goteo a una velocidad de 2 a 20 ng/kg por minuto durante 30-60 minutos, hasta 6 veces al día.
La prostaciclina, además de su potente efecto antiagregante, posee un potente efecto vasodilatador y broncodilatador. El fármaco dilata los vasos del cerebro, el corazón, los riñones, el músculo esquelético y los vasos mesentéricos. Bajo la influencia de la prostaciclina, aumenta el flujo sanguíneo coronario, aumenta el aporte energético al miocardio y disminuye su necesidad de oxígeno. A pesar de su inestabilidad en el organismo, sus efectos clínicamente favorables pueden durar varias semanas e incluso meses. El mecanismo de esta acción prolongada aún no está claro.
La prostaciclina es un fármaco poco tóxico, pero su uso puede causar efectos secundarios: enrojecimiento facial, cefaleas, disminución de la presión arterial, dolor abdominal y anorexia. Junto con la prostaciclina, sus análogos sintéticos estables (iloprost, etc.) son prometedores inhibidores de la agregación plaquetaria.
Medicamentos que mejoran la viscosidad sanguínea
Las alteraciones en las propiedades reológicas de la sangre durante traumatismos y shock se deben no solo a cambios en la actividad funcional de las plaquetas, sino también a un aumento de la viscosidad sanguínea. La viscosidad estructural de la sangre, como sistema dinámico complejo y disperso, está determinada en gran medida por la viscosidad del plasma y la capacidad de los eritrocitos para deformarse. La viscosidad plasmática depende principalmente de la concentración de proteínas en sangre. Las proteínas de bajo peso molecular, como la albúmina, tienen poco efecto sobre la viscosidad plasmática, mientras que las proteínas de gran peso molecular (fibrinógeno, alfaglobulinas y gammaglobulinas, y otras macromoléculas) la aumentan significativamente.
A bajas tasas de cizallamiento, la adsorción de fibrinógeno y globulinas en la superficie de los eritrocitos conduce a la formación de puentes entre células adyacentes y a la formación de agregados a partir de ellos. La tasa de formación de agregados es un proceso biofísico complejo que depende no solo de la magnitud del cizallamiento, sino también de las propiedades electrocinéticas de los eritrocitos, la concentración, la masa y la capacidad de sorción de las macromoléculas agregadoras, y de la forma y la plasticidad de los eritrocitos.
Mantener la forma y las propiedades mecánicas de la membrana eritrocitaria requiere un gasto energético significativo. Se cree que la energía producida en los eritrocitos durante la glucólisis se destina a la fosforilación de la espectrina, lo que produce cambios en la estructura secundaria de la proteína y la interacción con los componentes vecinos de la membrana interna. La interacción entre las proteínas estructurales de la membrana, la espectrina y la actina, desempeña un papel importante en la formación de las propiedades mecánicas de la membrana eritrocitaria, manteniendo constante su superficie y su grosor ante cualquier deformación.
En caso de trastornos hemodinámicos sistémicos y del flujo sanguíneo orgánico, el aumento de la rigidez de las membranas eritrocitarias y la formación de agregados eritrocitarios disminuyen la velocidad de paso de los eritrocitos a través de los capilares, alterando así la función de transporte de gases de la sangre. Por lo tanto, la corrección de los trastornos de las propiedades reológicas de la sangre en estado de shock debe incluir, además de la prevención de la agregación eritrocitaria, la normalización de la viscosidad plasmática y sanguínea, así como la agregación y la deformación de los eritrocitos.
Además de los dextranos de bajo peso molecular, las soluciones de albúmina son un medio eficaz para aumentar la estabilidad de la suspensión sanguínea. En la fase tardía del shock, se produce una agregación generalizada de eritrocitos en un contexto de disminución de la concentración de albúmina en el plasma sanguíneo y aumento de la concentración de fibrinógeno y globulinas, especialmente la fracción alfa2, lipoproteínas y lípidos. En estas condiciones, los efectos reológicos de la albúmina se deben a dos factores principales: la hemodilución y la normalización de la proporción entre proteínas microglobulares y macroglobulares en plasma. Al mismo tiempo, la albúmina se une a los ácidos libres, cuya labilización durante el trauma y el shock estimula la agregación de las estructuras celulares de la sangre y la coagulación intravascular, pudiendo causar embolia grasa.
Las medidas antichoque, dirigidas a reponer el volumen sanguíneo circulante y eliminar la hipoxia tisular y la acidosis metabólica, contribuyen a la normalización de la elasticidad de las membranas eritrocitarias, ya que la hipoxia y la acidosis reducen significativamente su deformabilidad. El aumento de la rigidez de las membranas eritrocitarias en estado de shock probablemente se asocia con la inhibición de la síntesis de ATP en los eritrocitos. A su vez, una disminución de la concentración de ATP contribuye a un aumento de la concentración de Ca₂+ en los eritrocitos, el cual, al unirse a las proteínas de membrana, aumenta la rigidez de la membrana.
Uno de los fármacos farmacológicos que aumenta el contenido de ATP en los eritrocitos y la elasticidad de las membranas eritrocitarias es el Trental (pentoxifilina), que se utiliza en la práctica clínica para tratar trastornos isquémicos.
Además de reducir la rigidez de las membranas de los eritrocitos, Trental provoca vasodilatación, mejora la oxigenación tisular, inhibe la actividad de la fosfodiesterasa en los tejidos, aumenta la concentración de AMPc e inhibe la agregación plaquetaria.
Entre otros agentes farmacológicos que mantienen la elasticidad de la membrana eritrocitaria, cabe destacar los antagonistas del Ca2+, que limitan el flujo de iones hacia los eritrocitos (flunarizina, nifedipino, etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
¡Atención!
Para simplificar la percepción de la información, esta instrucción para el uso del medicamento "Medicamentos que previenen la trombosis y mejoran la reología sanguínea" se traduce y se presenta en una forma especial sobre la base de las instrucciones oficiales para el uso médico del medicamento. Antes de usar, lea la anotación que vino directamente al medicamento.
Descripción proporcionada con fines informativos y no es una guía para la autocuración. La necesidad de este medicamento, el propósito del régimen de tratamiento, los métodos y la dosis del medicamento están determinados únicamente por el médico tratante. La automedicación es peligrosa para su salud.

