
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Papel de los cambios en el hueso subcondral en la patogénesis de la osteoartritis
Médico experto del artículo.
Último revisado: 04.07.2025
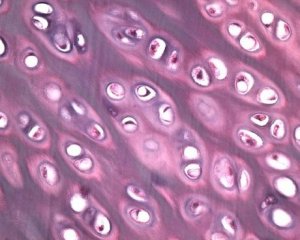
Junto con la degeneración del cartílago articular, el tejido óseo subyacente también participa en el proceso patológico de la osteoartrosis. Se supone que el engrosamiento de la placa subcondral contribuye a la progresión de la osteoartrosis. A medida que la osteoartrosis progresa, el cartílago articular, sujeto a estrés mecánico y químico, se erosiona lentamente debido a un desequilibrio en los procesos de catabolismo y reparación del cartílago. En particular, el estrés mecánico en relación con las articulaciones que soportan el peso corporal contribuye a la formación de un gran número de microfracturas en la placa subcondral y el cartílago. A medida que el cartílago articular se erosiona, la esclerosis del hueso subcondral progresa y la rigidez del tejido óseo aumenta, lo que a su vez contribuye a una mayor alteración de la estructura del cartílago articular. Sin embargo, la cuestión de la naturaleza primaria o secundaria de los cambios en el hueso subcondral en la osteoartrosis sigue sin resolverse.
Hasta hace poco, los cambios radiográficamente detectables en la sustancia esponjosa del hueso subcondral, como la esclerosis o la formación de quistes, se consideraban secundarios en pacientes con osteoartrosis. Sin embargo, los resultados de estudios clínicos y experimentales indican un posible papel del hueso subcondral en la patogénesis de la osteoartrosis. Uno de los posibles mecanismos es un aumento brusco del gradiente de rigidez del hueso subcondral, debido a que la integridad del tejido cartilaginoso subyacente depende de las propiedades mecánicas de su lecho óseo. Estudios en primates han demostrado que los cambios en el hueso subcondral pueden preceder a los cambios en el cartílago articular. La evidencia a favor y en contra de esta hipótesis, surgida a raíz de estudios en modelos animales de osteoartrosis y estudios clínicos, no ha hecho más que intensificar el debate. El engrosamiento de las trabéculas del hueso subcondral no siempre se acompaña de un aumento de la mineralización ósea, o mejor dicho, de un aumento del volumen de osteoide. Este signo de mineralización anormal indica que la alteración de la regulación de la remodelación ósea es parte integral de la osteoartritis y también respalda el concepto de un defecto de las células óseas en la osteoartritis. El grupo de J. Dequeker (1989) considera esta última como una «enfermedad ósea metabólica generalizada».
El tejido óseo se renueva constantemente. Este proceso dinámico, llamado remodelación ósea, es una secuencia compleja de reabsorción y mineralización. Los osteoclastos resorben el tejido óseo y los osteoblastos secretan proteínas que forman el principal componente orgánico para la mineralización. La formación y resorción ósea no ocurre aleatoriamente en todo el esqueleto; es un proceso programado que ocurre en diferentes áreas del esqueleto, llamadas unidades de remodelación ósea. Temprano en el ciclo, los osteoclastos aparecen en la superficie inactiva; dentro de las 2 semanas, forman un túnel en el hueso cortical o una laguna en la superficie del hueso trabecular. La frecuencia de activación de nuevas unidades de remodelación ósea determina el grado de renovación ósea. En una persona joven sana, los procesos de formación y resorción ósea están equilibrados y se mantiene una masa ósea normal. En la regulación hormonal de la resorción del tejido óseo, al menos la PTH y la PGE2 , no solo participan los osteoclastos sino también los osteoblastos, ya que bajo la influencia de estas hormonas, se liberan factores que estimulan la resorción ósea por los osteoclastos. Actualmente se conocen más de 12 reguladores locales y sistémicos del crecimiento del tejido óseo que afectan a su remodelación, en particular PTH, 1,25(OH) 2D3 ,calcitonina, hormona del crecimiento, glucocorticoides, hormonas tiroideas, insulina, IGF (1 y 2), estrógenos, PGE2 , andrógenos.
Las células óseas liberan diversas proteínas y citocinas que realizan la regulación endocrina y la transducción de señales. Las proteínas producidas por los osteoblastos incluyen proteínas de la matriz ósea como el colágeno, la osteopontina, la osteocalcina y las sialoproteínas óseas. Además, estas células liberan proteasas, tanto activas como latentes, que participan en el proceso de remodelación del tejido óseo (MMP), componentes del sistema activador del plasminógeno (PA)/plasmina. Las citocinas liberadas por los osteoblastos pueden actuar tanto a través de mecanismos autocrinos como de vías paracrinas en células locales (otros osteoblastos, osteoclastos).
Aún se desconoce si estas señales están reguladas por el estrés mecánico u otras señales químicas inducidas por él. Sin embargo, se sabe que el estrés mecánico repetido provoca la proliferación local de células y/o proteínas óseas. In vivo, la carga mecánica puede activar osteoblastos, aumentar el nivel de nucleótidos cíclicos y la producción de prostaglandinas, y causar cambios morfológicos asociados con la remodelación ósea. In vitro, el estrés mecánico provoca la proliferación de cultivos de osteoblastos, la expresión del ARNm de proteínas óseas implicadas en la formación y mineralización de osteoides, la liberación de factores de crecimiento locales como IGF-1 e IGF-2, y moléculas de adhesión. La transmisión de la señal de estrés mecánico puede realizarse a través de canales iónicos mecanosensibles.
Existe evidencia indirecta de disfunción osteoblástica en la osteoartrosis. G. Gevers y J. Dequeker (1987) demostraron un aumento en los niveles séricos de osteocalcina en mujeres con osteoartrosis de mano, así como en explantos de hueso cortical, lo que indica que la patología ósea podría ser parte de la osteoartrosis. La autopsia reveló no solo engrosamiento del hueso subcondral, sino también una mineralización anormalmente baja de la cabeza femoral. En cobayas con osteoartrosis inducida quirúrgicamente, la tomografía computarizada reveló un engrosamiento significativo de la fracción ósea en la zona subcondral. Un desequilibrio entre las proteínas colágenas y no colágenas (osteocalcina, etc.) puede conducir a un aumento en el volumen óseo, pero no afecta su densidad mineral. Según M. Shimizu et al. (1993), la progresión de los cambios degenerativos en el cartílago articular se asocia con una remodelación más intensiva del hueso subcondral y un aumento en su rigidez, lo que también indica un defecto en las células del tejido óseo en la osteoartrosis. Según la hipótesis propuesta por B. Lee y M. Aspden (1997), la proliferación de células óseas defectuosas puede conducir a un aumento de la rigidez del tejido óseo, pero no provoca un aumento de su densidad mineral.
CI Westacott et al. (1997) plantearon la hipótesis de que los osteoblastos anormales afectan directamente el metabolismo del cartílago. Al cultivar osteoblastos de pacientes con osteoartritis con condrocitos de personas sin enfermedades articulares, los autores observaron un cambio significativo en la liberación de glicosaminoglicanos por el tejido cartilaginoso normal in vitro, pero el nivel de liberación de citocinas se mantuvo sin cambios. G. Hilal et al. (1998) demostraron que el cultivo de osteoblastos de hueso subcondral de pacientes con osteoartritis in vitro presenta un metabolismo alterado: la actividad del sistema AP/plasmina y el nivel de IGF-1 en estas células aumentan. La observación de CI Westacott et al. (1997) puede explicarse por un aumento en la actividad de las proteasas en las células del hueso subcondral.
Sigue siendo desconocido si los cambios en el hueso subcondral inician la osteoartritis o contribuyen a su progresión. DK Dedrick et al. (1993) demostraron que en perros con osteoartritis inducida quirúrgicamente, el engrosamiento del hueso subcondral no es una condición necesaria para el desarrollo de cambios similares a la osteoartrosis en el cartílago articular, pero contribuye a la progresión de los procesos degenerativos en el cartílago. Los resultados del estudio de A. Sa'ied et al. (1997) contradicen los datos del estudio previo. Utilizando la ecografía de 50 MHz para evaluar los cambios morfológicos iniciales y su progresión en el cartílago articular y el hueso en la osteoartritis experimental inducida por inyecciones de ácido monoyodoacético en la articulación de la rodilla de ratas, los autores demostraron un proceso simultáneo de cambios en el hueso y el cartílago durante los primeros tres días después de la inyección.
Los osteoblastos secretan factores de crecimiento y citocinas implicadas en la remodelación ósea local, que pueden promover la remodelación del cartílago adecuado en las articulaciones de "soporte de peso" después de su penetración a través de microfisuras en la capa calcificada del cartílago articular. Además, los productos de secreción de las células óseas se encuentran en el líquido sinovial. Los productos secretados por osteoblastos anormales que con mayor probabilidad pueden iniciar el proceso de remodelación local del cartílago son el TGF-β y las proteínas morfométricas óseas (BMP). Ambos miembros de la familia TGF son secretados tanto por condrocitos como por osteoblastos, y ambos son capaces de modificar la remodelación tanto del hueso como del cartílago. J. Martel Pelletier et al. (1997) observaron un aumento en el nivel de TGF-β en explantos óseos subcondrales de pacientes con osteoartrosis en comparación con individuos sanos, lo que indica un probable papel de este factor de crecimiento en la patogénesis de la osteoartrosis. Los osteoblastos también producen IGF. En un cultivo de células tipo osteoblastos obtenidas de pacientes con osteoartrosis, se encontró un aumento en el nivel de IGF, que alteran el metabolismo del cartílago.
El TGF-β, el IGF, la BMP y las citocinas producidas por los osteoblastos en el hueso subcondral pueden influir en la producción de colagenasa y otras enzimas proteolíticas en el cartílago, lo que a su vez puede promover la remodelación/degradación de la matriz cartilaginosa. Aún no está claro si los osteoblastos en la OA producen menos factor estimulante de colonias de macrófagos (M-CSF, un estimulador de la resorción ósea) que las células normales. Los resultados de los estudios de AG Uitterlinden et al. (1997) mostraron que los receptores de vitamina D, que son expresados por los osteoblastos y regulan la expresión de varios factores sintetizados por estas células, pueden desempeñar un papel en la formación de osteofitos, lo que explica parcialmente el papel de los osteoblastos en la patogénesis de esta enfermedad.
Teniendo en cuenta los resultados de los estudios anteriores, G. Hilal et al. (1998), J. Martel-Pelletier et al. (1997) propusieron la siguiente hipótesis de trabajo sobre la relación entre la remodelación del hueso subcondral y el cartílago articular adecuado en la osteoartrosis. En una etapa temprana o avanzada de la patogénesis de la OA, el proceso de remodelación del tejido óseo en el hueso subcondral se intensifica. Al mismo tiempo, la carga repetida conduce a microfracturas locales y/o a la aparición de un desequilibrio en el sistema IGF/proteína de unión a IGF (IGFBP) debido a una respuesta anormal de los osteoblastos del hueso subcondral, lo que contribuye a su esclerosis. Esto último, a su vez, puede contribuir a la aparición de microfracturas del cartílago adecuado y al daño de su matriz.
En condiciones normales, este daño se repara mediante la síntesis y liberación local de IGF-1 y la proteína de unión a IGF, que estimulan la formación de la matriz extracelular del cartílago articular. Al mismo tiempo, el sistema GF promueve el crecimiento de las células óseas subcondrales y la formación de la matriz ósea. La actividad anabólica del sistema IGF aumenta en el hueso subcondral de pacientes con osteoartrosis, mientras que la activación local del sistema AP/plasmina (un regulador local del sistema IGF) en el cartílago articular causa sus cambios locales. En los osteoblastos en la osteoartrosis, el IGF-1 interrumpe la regulación de AP por plasmina por el tipo de retroalimentación positiva, por lo tanto, puede restringir la remodelación en el tejido óseo, lo que finalmente conduce a la esclerosis subcondral. Así, en el tejido óseo y cartilaginoso, la inducción local de IGF-1 y proteasas provoca, por un lado, daño del cartílago y, por otro, engrosamiento del hueso subcondral, lo que a su vez contribuye a un mayor daño del cartílago. El desequilibrio entre el daño del cartílago asociado a la esclerosis subcondral y su capacidad reparadora provoca cambios progresivos en la matriz extracelular (MEC) del cartílago y el desarrollo de osteoartrosis. Según los autores, esta hipótesis también explica la lenta progresión de la enfermedad.

