
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Ovario
Médico experto del artículo.
Último revisado: 04.07.2025

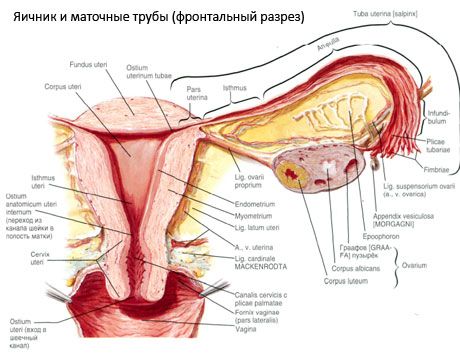
El ovario (ovario; del griego ooforon) es un órgano par, una glándula reproductora femenina, ubicada en la cavidad pélvica detrás del ligamento ancho del útero. En los ovarios, las células reproductoras femeninas (óvulos) se desarrollan y maduran, y se forman las hormonas sexuales femeninas que ingresan a la sangre y la linfa. El ovario tiene forma ovoide, ligeramente aplanado en dirección anteroposterior. Su color es rosado. En la superficie del ovario de una mujer que ha dado a luz, son visibles depresiones y cicatrices: rastros de la ovulación y la transformación de los cuerpos lúteos. El ovario pesa entre 5 y 8 g. Las dimensiones del ovario son: largo 2,5-5,5 cm, ancho 1,5-3,0 cm, grosor: hasta 2 cm. El ovario tiene dos superficies libres: la cara medial (facies medialis), orientada hacia la cavidad pélvica y parcialmente cubierta por la trompa de Falopio, y la cara lateral (facies lateralis), adyacente a la pared lateral de la pelvis, a una depresión ligeramente pronunciada: la fosa ovárica. Esta fosa se ubica en el ángulo entre los vasos ilíacos externos, cubiertos de peritoneo en la parte superior, y las arterias uterina y obturatriz en la inferior. Detrás del ovario, el uréter del lado correspondiente discurre retroperitonealmente de arriba a abajo.
Las superficies del ovario pasan a un borde libre (posterior) convexo (margo liber), por delante, al borde mesentérico (margo mesovaricus), unido mediante un pliegue corto del peritoneo (mesenterio del ovario) a la valva posterior del ligamento ancho del útero. En este borde anterior del órgano hay una depresión acanalada: el hilio del ovario (hilum ovarii), a través del cual la arteria y los nervios entran en el ovario, y las venas y los vasos linfáticos salen. El ovario también tiene dos extremos: el extremo tubular superior redondeado (extremitas tubaria), orientado hacia la trompa de Falopio, y el extremo uterino inferior (extremitas utenna), conectado al útero por el ligamento ovárico (lig. ovarii proprium). Este ligamento, en forma de cordón redondo de unos 6 mm de grosor, va desde el extremo uterino del ovario hasta el ángulo lateral del útero, situado entre las dos hojas del ligamento ancho del útero. El aparato ligamentoso del ovario también incluye el ligamento suspensorio del ovario (lig.suspensorium ovarii), que es un pliegue del peritoneo que va desde la pared de la pelvis pequeña hasta el ovario y contiene los vasos ováricos y haces de fibras fibrosas en su interior. El ovario está fijado por un mesenterio corto (mesovario), que es una duplicación del peritoneo que va desde la valva posterior del ligamento ancho del útero hasta el borde mesentérico del ovario. Los ovarios en sí no están cubiertos por el peritoneo. La franja ovárica más grande de la trompa de Falopio está unida al extremo tubular del ovario. La topografía del ovario depende de la posición del útero y de su tamaño (durante el embarazo). Los ovarios son órganos muy móviles de la pequeña cavidad pélvica.
Vasos y nervios del ovario
El suministro de sangre a los ovarios es proporcionado por aa. et vv. ovaricae et uterinae. Ambas arterias ováricas (aa. ovaricae dextra et sinistra) se originan en la superficie anterior de la aorta justo debajo de las arterias renales; la derecha generalmente se origina en la aorta y la izquierda en la arteria renal. Dirigiéndose hacia abajo y lateralmente a lo largo de la superficie anterior del músculo psoas mayor, cada arteria ovárica cruza el uréter por delante (dándole ramas), los vasos ilíacos externos, la línea limítrofe y entra en la cavidad pélvica, ubicándose aquí en el ligamento suspensorio del ovario. Siguiendo en dirección medial, la arteria ovárica pasa entre las hojas del ligamento ancho del útero debajo de la trompa de Falopio, dándole ramas, y luego dentro del mesenterio del ovario; entra en el hilio del ovario.
Las ramas de la arteria ovárica se anastomosan ampliamente con las ramas ováricas de la arteria uterina. El flujo venoso de los ovarios se dirige principalmente al plexo venoso ovárico, ubicado en la región del hilio ovárico. Desde aquí, el flujo sanguíneo circula en dos direcciones: a través de las venas uterina y ovárica. La vena ovárica derecha tiene válvulas y desemboca en la vena cava inferior. La vena ovárica izquierda desemboca en la vena renal izquierda, aunque no tiene válvulas.
El drenaje linfático de los ovarios se produce a través de los vasos linfáticos, especialmente abundante en la zona de la entrada del órgano, donde se distingue el plexo linfático subovárico. Posteriormente, la linfa se descarga a través de los vasos linfáticos ováricos hasta los ganglios linfáticos paraaórticos.
Inervación de los ovarios
Simpático: proporcionado por fibras posganglionares de los plexos celíaco (solar), mesentérico superior e hipogástrico; parasimpático: proporcionado por los nervios sacros viscerales.
Estructura del ovario
La superficie del ovario está cubierta por un epitelio germinal monocapa. Debajo se encuentra una densa capa proteica de tejido conectivo (túnica albugínea). El tejido conectivo del ovario forma su estroma (estroma ovárico), rico en fibras elásticas. El parénquima del ovario se divide en capas externa e interna. La capa interna, ubicada en el centro del ovario, más cerca de su entrada, se denomina médula (médula ovárica). En esta capa, de tejido conectivo laxo, se encuentran numerosos vasos sanguíneos y linfáticos, así como nervios. La capa externa del ovario, la corteza (corteza ovárica), es más densa. Contiene una gran cantidad de tejido conectivo, en el que se encuentran los folículos ováricos primarios en maduración (folliculi ovarici primarii), los folículos secundarios (vesiculares) (folliculi ovarici secundarii, s.vesiculosi), así como los folículos maduros, los folículos de Graaf (folliculi ovarici maturis), así como los cuerpos amarillos y atrésicos.
Cada folículo contiene un óvulo reproductor femenino, u ovocito (ovocitos). El óvulo mide hasta 150 µm de diámetro, es redondo y contiene un núcleo y una gran cantidad de citoplasma que, además de orgánulos celulares, contiene inclusiones proteico-lipídicas (yema) y glucógeno, necesarios para su nutrición. El óvulo suele agotar sus reservas de nutrientes entre 12 y 24 horas después de la ovulación. Si no se produce la fecundación, muere.
El óvulo humano está recubierto por dos membranas. En su interior se encuentra el citolema, que es la membrana citoplasmática del óvulo. En el exterior del citolema se encuentra una capa de células foliculares, que protegen al óvulo y desempeñan una función formadora de hormonas: secretan estrógenos.
La posición fisiológica del útero, las trompas y los ovarios se determina mediante los aparatos de suspensión, fijación y soporte que unen el peritoneo, los ligamentos y el tejido pélvico. El aparato de suspensión está representado por pares de estructuras e incluye los ligamentos redondo y ancho del útero, los ligamentos propios y los ligamentos de suspensión de los ovarios. Los ligamentos anchos del útero, los ligamentos propios y los ligamentos de suspensión de los ovarios mantienen el útero en posición media. Los ligamentos redondos empujan el fondo uterino hacia adelante y proporcionan su inclinación fisiológica.
El aparato de fijación (anclaje) asegura la posición del útero en el centro de la pelvis pequeña e impide prácticamente su desplazamiento lateral o lateral. Sin embargo, dado que el aparato ligamentoso parte del útero en su sección inferior, este puede inclinarse en diversas direcciones. El aparato de fijación incluye ligamentos ubicados en el tejido laxo de la pelvis y que se extienden desde la sección inferior del útero hasta las paredes lateral, anterior y posterior: ligamentos sacromágico, cardinal, uterovesical y vesicopúbico.
Además del mesovario, se distinguen los siguientes ligamentos ováricos:
- El ligamento suspensorio del ovario, anteriormente denominado ligamento infundibulopélvico, es un pliegue del peritoneo atravesado por vasos sanguíneos (a. et v. ovarica), vasos linfáticos y nervios del ovario, que se extiende entre la pared lateral de la pelvis, la fascia lumbar (en la zona de división de la arteria ilíaca común en externa e interna) y el extremo superior (tubárico) del ovario.
- El ligamento propio del ovario discurre entre las hojas del ligamento uterino ancho, más cerca de la hoja posterior, y conecta el extremo inferior del ovario con el borde lateral del útero. El ligamento propio del ovario se inserta en el útero entre el inicio de la trompa de Falopio y el ligamento redondo, por detrás y por encima de este último. En el espesor del ligamento discurren los ovarios rectos, que son las ramas terminales de la arteria uterina.
- Ligamento apendicular-ovárico. El ligamento se extiende desde el mesenterio del apéndice hasta el ovario derecho o ligamento ancho del útero, formando un pliegue del peritoneo. Es inconstante y se observa en entre la mitad y un tercio de las mujeres.
El aparato de sostén está representado por los músculos y la fascia del suelo pélvico, divididos en capas inferior, media y superior (interna).
La capa muscular más potente es la superior (interna), representada por el músculo par que eleva el ano. Está formada por haces musculares que se extienden desde el cóccix hasta los huesos pélvicos en tres direcciones (pubococcígeo, iliococcígeo e isquiococcígeo). Esta capa muscular también se denomina diafragma pélvico.
La capa muscular media se encuentra entre la sínfisis y los huesos púbicos e isquiáticos. Esta capa muscular, el diafragma urogenital, ocupa la mitad anterior del estrecho inferior de la pelvis, por donde pasan la uretra y la vagina. En la sección anterior, entre sus láminas, se encuentran haces musculares que forman el esfínter externo de la uretra; en la sección posterior, se encuentran haces musculares que se extienden en dirección transversal: el músculo transverso profundo del perineo.
La capa inferior (externa) de los músculos del suelo pélvico está formada por músculos superficiales, cuya forma se asemeja al número 8. Estos incluyen el bulbocavernoso, el isquiocavernoso, el esfínter anal externo y el músculo perineal transverso superficial.
Ontogénesis de los ovarios
El proceso de crecimiento folicular y atresia comienza a las 20 semanas de embarazo, y para el momento del parto, hasta 2 millones de ovocitos permanecen en los ovarios de la niña. Para la menarquia, su número disminuye a 300 mil. Durante todo el período de vida reproductiva, no más de 500 folículos alcanzan la madurez y ovulan. El crecimiento inicial de los folículos no depende de la estimulación de FSH, es limitado y la atresia ocurre rápidamente. Se cree que en lugar de las hormonas esteroides, los péptidos autocrinos/paracrinos locales son el principal regulador del crecimiento y la atresia de los folículos primarios. Se cree que el proceso de crecimiento folicular y atresia no se interrumpe por ningún proceso fisiológico. Este proceso continúa en todas las edades, incluido el período intrauterino y la menopausia, y se interrumpe por el embarazo, la ovulación y la anovulación. El mecanismo que desencadena el crecimiento folicular y su número en cada ciclo específico aún no está claro.
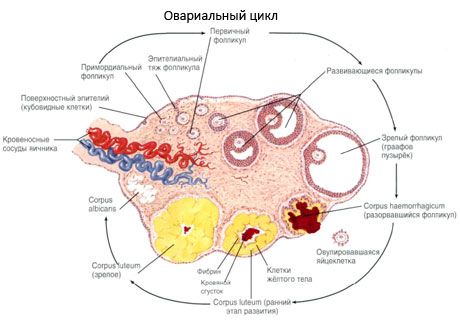
Durante su desarrollo, el folículo atraviesa varias etapas. Las células germinales primordiales se originan en el endodermo del saco vitelino, la alantoides, y migran al área genital del embrión entre las 5 y 6 semanas de gestación. Como resultado de la rápida división mitótica, que continúa desde la semana 6-8 hasta la semana 16-20 de gestación, se forman hasta 6-7 millones de ovocitos en los ovarios del embrión, rodeados por una fina capa de células de la granulosa.
Folículo preantral: el ovocito está rodeado por una membrana (zona pelúcida). Las células de la granulosa que rodean al ovocito comienzan a proliferar; su crecimiento depende de las gonadotropinas y se correlaciona con el nivel de estrógenos. Las células de la granulosa son el objetivo de la FSH. En la etapa del folículo preantral, las células de la granulosa son capaces de sintetizar tres clases de esteroides: inducen predominantemente la actividad de la aromatasa, la principal enzima que convierte los andrógenos en estradiol. Se cree que el estradiol es capaz de aumentar el número de sus propios receptores, ejerciendo un efecto mitogénico directo sobre las células de la granulosa, independiente de la FSH. Se considera un factor paracrino que potencia los efectos de la FSH, incluyendo la activación de los procesos de aromatización.
Los receptores de FSH aparecen en las membranas de las células de la granulosa en cuanto comienza el crecimiento folicular. Una disminución o un aumento de la FSH provoca un cambio en el número de sus receptores. Esta acción de la FSH está modulada por factores de crecimiento. La FSH actúa a través de la proteína G, el sistema de la adenilato ciclasa. Si bien la esteroidogénesis en el folículo está regulada principalmente por la FSH, en este proceso intervienen numerosos factores: canales iónicos, receptores de tirosina quinasa y el sistema de fosfolipasas de segundos mensajeros.
El papel de los andrógenos en el desarrollo folicular temprano es complejo. Las células de la granulosa poseen receptores de andrógenos. Estos no solo constituyen un sustrato para la aromatización a estrógenos inducida por la FSH, sino que también pueden potenciar la aromatización a bajas concentraciones. Cuando aumentan los niveles de andrógenos, las células de la granulosa preantrales prefieren no la vía de aromatización a estrógenos, sino la vía androgénica más simple, a través de la 5α-reductasa, para convertir un andrógeno que no puede convertirse en estrógeno, inhibiendo así la actividad de la aromatasa. Este proceso también inhibe la formación de receptores de FSH y LH, deteniendo así el desarrollo folicular.
Durante el proceso de aromatización, el folículo con altos niveles de andrógenos sufre atresia. El crecimiento y desarrollo del folículo dependen de su capacidad para convertir los andrógenos en estrógenos.
En presencia de FSH, la sustancia dominante del líquido folicular serán los estrógenos. En ausencia de FSH, los andrógenos. La LH normalmente está ausente en el líquido folicular hasta la mitad del ciclo. Tan pronto como el nivel de LH aumenta, la actividad mitótica de las células de la granulosa disminuye, aparecen cambios degenerativos y el nivel de andrógenos en el folículo aumenta. El nivel de esteroides en el líquido folicular es más alto que en el plasma y refleja la actividad funcional de las células ováricas: células de la granulosa y de la teca. Si el único objetivo de la FSH son las células de la granulosa, entonces la LH tiene muchos objetivos: células de la teca, células del estroma y luteínicas y células de la granulosa. Tanto las células de la granulosa como las de la teca tienen la capacidad de esteroidogénesis, pero la actividad de la aromatasa predomina en las células de la granulosa.
En respuesta a la LH, las células de la teca producen andrógenos, que luego son convertidos por las células de la granulosa en estrógenos a través de la aromatización inducida por FSH.
A medida que el folículo crece, las células de la teca comienzan a expresar genes para los receptores de LH, P450 sec y 3beta-hidroxiesteroide deshidrogenasa, el factor de crecimiento similar a la insulina (IGF-1) sinérgicamente con la LH aumenta la expresión genética, pero no estimula la esteroidogénesis.
La esteroidogénesis ovárica siempre depende de la LH. A medida que el folículo crece, las células de la teca expresan la enzima P450c17, que forma andrógenos a partir del colesterol. Las células de la granulosa no poseen esta enzima y dependen de las células de la teca para producir estrógenos a partir de los andrógenos. A diferencia de la esteroidogénesis, la foliculogénesis depende de la FSH. A medida que el folículo crece y aumentan los niveles de estrógenos, se activa un mecanismo de retroalimentación: se inhibe la producción de FSH, lo que a su vez conduce a una disminución de la actividad de la aromatasa del folículo y, en última instancia, a la atresia folicular por apoptosis (muerte celular programada).
El mecanismo de retroalimentación de los estrógenos y la FSH inhibe el desarrollo de los folículos que han comenzado a crecer, pero no el folículo dominante. Este último contiene más receptores de FSH, que favorecen la proliferación de las células de la granulosa y la aromatización de los andrógenos a estrógenos. Además, las vías paracrinas y autocrinas actúan como un importante coordinador del desarrollo del folículo antral.
El regulador autocrino/paracrino consiste en péptidos (inhibina, activina, folistatina), sintetizados por las células de la granulosa en respuesta a la FSH y que entran en el líquido folicular. La inhibina reduce la secreción de FSH; la activina estimula la liberación de FSH desde la hipófisis y potencia su acción en el ovario; la folistatina suprime la actividad de la FSH, posiblemente mediante su unión a la activina. Tras la ovulación y el desarrollo del cuerpo lúteo, la inhibina queda bajo el control de la LH.
El crecimiento y la diferenciación de las células ováricas se ven influenciados por los factores de crecimiento similares a la insulina (IGE). El IGF-1 actúa sobre las células de la granulosa, provocando un aumento del monofosfato de adenosina cíclico (AMPc), la progesterona, la oxitocina, el proteoglicano y la inhibina.
El IGF-1 actúa sobre las células de la teca, provocando un aumento en la producción de andrógenos. Las células de la teca, a su vez, producen el factor de necrosis tumoral (TNF) y el factor de crecimiento epidérmico (EGF), que también están regulados por la FSH.
El EGF estimula la proliferación de las células de la granulosa. El IGF-2 es el principal factor de crecimiento del líquido folicular, y también contiene IGF-1, TNF-α, TNF-γ y EGF.
La alteración de la regulación paracrina y/o autocrina de la función ovárica parece desempeñar un papel en los trastornos de la ovulación y en el desarrollo de ovarios poliquísticos.
A medida que el folículo antral crece, el contenido de estrógenos en el líquido folicular aumenta. En el punto máximo de su crecimiento, aparecen receptores de LH en las células de la granulosa, se produce la luteinización de estas células y aumenta la producción de progesterona. Así, en el período preovulatorio, un aumento en la producción de estrógenos provoca la aparición de receptores de LH, la cual, a su vez, provoca la luteinización de las células de la granulosa y la producción de progesterona. Un aumento de progesterona reduce los niveles de estrógenos, lo que aparentemente provoca un segundo pico de FSH a mitad del ciclo.
Se cree que la ovulación ocurre entre 10 y 12 horas después del pico de LH y entre 24 y 36 horas después del pico de estradiol. Se cree que la LH estimula la división reductora del ovocito, la luteinización de las células de la granulosa y la síntesis de progesterona y prostaglandina en el folículo.
La progesterona potencia la actividad de las enzimas proteolíticas, que, junto con la prostaglandina, participan en la ruptura de la pared folicular. El pico de FSH inducido por la progesterona permite que el ovocito salga del folículo mediante la conversión del plasminógeno en la enzima proteolítica plasmina, y proporciona un número suficiente de receptores de LH para el desarrollo normal de la fase lútea.
Dentro de los 3 días posteriores a la ovulación, las células de la granulosa aumentan de tamaño y aparecen en ellas vacuolas características llenas de pigmento, luteína. Las células teca-lúteas se diferencian de la teca y el estroma y pasan a formar parte del cuerpo lúteo. Los capilares que penetran en el cuerpo lúteo se desarrollan muy rápidamente bajo la influencia de factores de angiogénesis y, con una vascularización mejorada, aumenta la producción de progesterona y estrógenos. La actividad de la esteroidogénesis y la longevidad del cuerpo lúteo están determinadas por el nivel de LH. El cuerpo lúteo no es una formación celular homogénea. Además de 2 tipos de células lúteas, contiene células endoteliales, macrófagos, fibroblastos, etc. Las células lúteas grandes producen péptidos (relaxina, oxitocina) y son más activas en la esteroidogénesis con mayor actividad de aromatasa y mayor síntesis de progesterona que las células pequeñas.
El pico de progesterona se produce el octavo día después del pico de LH. Se observa que la progesterona y el estradiol se secretan episódicamente durante la fase lútea, en correlación con la secreción pulsátil de LH. Con la formación del cuerpo lúteo, el control de la producción de inhibina pasa de la FSH a la LH. La inhibina aumenta con el aumento del estradiol antes del pico de LH y continúa aumentando después de este, aunque los niveles de estrógeno disminuyen. Si bien la inhibina y el estradiol son secretados por las células de la granulosa, se regulan por vías diferentes. La disminución de la inhibina al final de la fase lútea contribuye al aumento de la FSH para el siguiente ciclo.
El cuerpo lúteo disminuye muy rápidamente: entre el 9º y el 11º día después de la ovulación.
El mecanismo de degeneración no está claro y no está relacionado con la función luteolítica de los estrógenos ni con un mecanismo relacionado con los receptores, como se observa en el endometrio. Existe otra explicación para la función de los estrógenos producidos por el cuerpo lúteo. Se sabe que los estrógenos son necesarios para la síntesis de receptores de progesterona en el endometrio. Los estrógenos de la fase lútea probablemente sean necesarios para los cambios relacionados con la progesterona en el endometrio después de la ovulación. El desarrollo inadecuado de los receptores de progesterona, como consecuencia de los niveles inadecuados de estrógenos, es posiblemente un mecanismo adicional para la infertilidad y las pérdidas prematuras de embarazos, otra forma de deficiencia de la fase lútea. Se cree que la esperanza de vida del cuerpo lúteo se establece en el momento de la ovulación. Y ciertamente regresará si no es apoyada por la gonadotropina coriónica humana debido al embarazo. Por lo tanto, la regresión del cuerpo lúteo conduce a una disminución en los niveles de estradiol, progesterona e inhibina. Una disminución en la inhibina elimina su efecto supresor sobre la FSH; una disminución en el estradiol y la progesterona permite una restauración muy rápida de la secreción de GnRH y la eliminación del mecanismo de retroalimentación de la glándula pituitaria. Una disminución en la inhibina y el estradiol, junto con un aumento en la GnRH, da lugar a FSH sobre LH. Un aumento en la FSH conduce al crecimiento del folículo con la subsiguiente selección de un folículo dominante, y un nuevo ciclo comienza si no se produce el embarazo. Las hormonas esteroides desempeñan un papel fundamental en la biología reproductiva y la fisiología general. Determinan el fenotipo humano, afectan el sistema cardiovascular, el metabolismo óseo, la piel, el bienestar general y desempeñan un papel clave en el embarazo. La acción de las hormonas esteroides refleja los mecanismos intracelulares y genéticos necesarios para transmitir una señal extracelular al núcleo celular para provocar una respuesta fisiológica.
Los estrógenos penetran difusamente la membrana celular y se unen a receptores ubicados en el núcleo celular. El complejo receptor-esteroide se une entonces al ADN. En las células diana, estas interacciones conducen a la expresión génica, la síntesis de proteínas y la función celular y tisular específica.
Использованная литература


 [
[