
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Los científicos han creado un compuesto "camaleónico" para tratar los cánceres cerebrales resistentes a los fármacos
Último revisado: 02.07.2025
Un nuevo estudio realizado por científicos de la Universidad de Yale describe cómo un nuevo compuesto químico ataca los tumores cerebrales resistentes a los medicamentos sin dañar el tejido sano circundante.
El estudio, publicado en el Journal of the American Chemical Society, es un paso importante en el desarrollo de los llamados "compuestos camaleón" que podrían usarse para combatir una variedad de cánceres peligrosos.
Los gliomas se desarrollan en aproximadamente 6,6 por cada 100.000 personas cada año y en 2,94 por cada 100.000 personas a los 14 años. Excluyendo las metástasis de otros cánceres que llegan al sistema nervioso central, los gliomas representan el 26% de todos los tumores cerebrales (tumores cerebrales primarios) y el 81% de todos los tumores cerebrales malignos.
Durante décadas, los pacientes con glioblastoma han recibido tratamiento con un fármaco llamado temozolomida. Sin embargo, la mayoría de los pacientes desarrollan resistencia a la temozolomida en el plazo de un año. La tasa de supervivencia a cinco años para los pacientes con glioblastoma es inferior al 5 %.
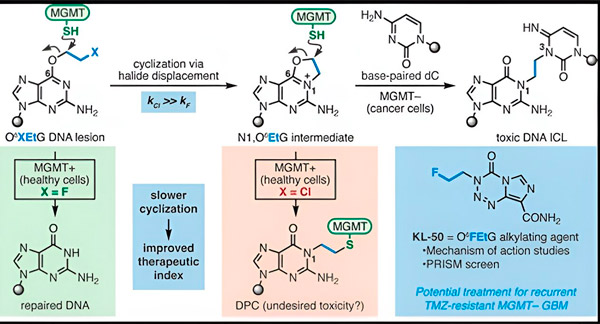
En 2022, el químico de Yale Seth Herzon y el oncólogo radioterapeuta Dr. Ranjit Bindra desarrollaron una nueva estrategia para tratar los glioblastomas con mayor eficacia. Crearon una clase de moléculas anticancerígenas llamadas compuestos camaleón que aprovechan un defecto en una proteína reparadora del ADN conocida como O6-metilguanina ADN metiltransferasa (MGMT).
Muchas células cancerosas, incluidos los glioblastomas, carecen de la proteína MGMT. Se han diseñado nuevos compuestos camaleónicos para dañar el ADN de las células tumorales que carecen de MGMT.
Los compuestos camaleónicos inician el daño al ADN al depositar lesiones primarias en él, que con el tiempo evolucionan a lesiones secundarias altamente tóxicas, conocidas como enlaces cruzados intercatenarios. La MGMT protege el ADN de los tejidos sanos reparando las lesiones primarias antes de que puedan evolucionar a enlaces cruzados intercatenarios mortales.
Para su nuevo estudio, los coautores Herzon y Bindra se centraron en su camaleón líder, KL-50.
"Utilizamos una combinación de estudios de química sintética y biología molecular para dilucidar la base molecular de nuestras observaciones previas, así como la cinética química que proporciona la selectividad única de estos compuestos", afirmó Herzon, profesor de Química Milton Harris en Yale. "Demostramos que el KL-50 es único, ya que forma enlaces cruzados de ADN solo en tumores con reparación defectuosa del ADN. No afecta al tejido sano".
Fuente: Revista de la Sociedad Química Americana (2024). DOI: 10.1021/jacs.3c06483
Esa es una diferencia significativa, señalan los investigadores. Se han diseñado otros compuestos anticancerígenos para desencadenar enlaces cruzados entre cadenas, pero no son selectivos para las células tumorales, lo que limita su utilidad.
El secreto del éxito de KL-50 reside en su sincronización, señalaron los investigadores. KL-50 forma enlaces cruzados entre cadenas más lentamente que otros agentes de enlaces cruzados. Este retraso proporciona a las células sanas tiempo suficiente para usar MGMT e impedir la formación de enlaces cruzados.
"Este perfil único sugiere su potencial para el tratamiento del glioblastoma farmacorresistente, un área con una gran necesidad insatisfecha en la práctica clínica", afirmó Bindra, profesor de Radiología Terapéutica Harvey y Kate Cushing en la Facultad de Medicina de Yale. Bindra también es director científico del Centro de Tumores Cerebrales de la Familia Chenevert del Hospital Smilo.
Herzon y Bindra afirmaron que su estudio destaca la importancia de considerar las tasas de modificación química del ADN y de reparación bioquímica del ADN. Creen que pueden utilizar esta estrategia para desarrollar tratamientos para otros tipos de cáncer que presentan defectos específicos en la reparación del ADN asociados a tumores.
