
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Cómo un embrión "muerde" el tejido materno: la mecánica de la implantación en humanos filmada en tiempo real por primera vez
Último revisado: 23.08.2025
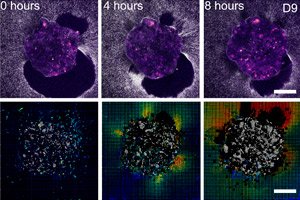 ">
">Científicos de Barcelona (IBEC, Dexeus Mujer) y Tel Aviv han demostrado por primera vez en tiempo real y en 3D cómo un embrión humano se adhiere al "andamio uterino" y, literalmente, tira y reestructura el tejido circundante. Para ello, crearon una plataforma deformable ex vivo (geles de colágeno/MEC) y aplicaron microscopía de fuerza de tracción directamente a embriones humanos y de ratón vivos. El hallazgo clave: el patrón de fuerzas es específico de cada especie, y los propios embriones son mecanosensibles: responden a señales mecánicas externas reestructurando el citoesqueleto y modificando la orientación de su crecimiento.
Antecedentes del estudio
La implantación es el "cuello de botella" de la reproducción humana: es en esta etapa donde tanto la concepción natural como los intentos de FIV suelen fracasar. Al mismo tiempo, la implantación humana es intersticial: el embrión no se "adhiere" simplemente, sino que se incrusta completamente en el endometrio; un proceso bioquímica y mecánicamente complejo, pero que hasta hace poco apenas se observaba en sistemas vivos humanos. Por lo tanto, la mecánica de adhesión e invasión seguía siendo un misterio, y las conclusiones a menudo se basaban en marcadores indirectos o datos de modelos animales.
La biología clásica de la implantación se ha basado en gran medida en el ratón, pero existen diferencias fundamentales entre especies, desde la orientación del blastocisto hasta la profundidad de implantación y el patrón de las fuerzas celulares. En ratones, la implantación es más superficial, con direcciones preferenciales de desplazamiento del tejido; en humanos, es claramente invasiva, con fuerzas de tracción multifocales alrededor del embrión. Estas diferencias sugieren que el modelo murino no siempre es escalable para los humanos, especialmente en lo que respecta a la mecánica. Se requerían observaciones directas del embrión humano en un entorno deformable.
Este avance tecnológico fue posible gracias a la combinación de matrices deformables 2D/3D (colágeno/ECM) y microscopía de fuerza de tracción con imágenes de alta frecuencia a largo plazo. Este «útero artificial» permitió ver y medir literalmente cómo el embrión tira, reestructura y perfora el tejido circundante, y cómo responde a señales mecánicas externas (mecanosensibilidad). Esto abre la puerta a nuevos criterios para evaluar el potencial de implantación y optimizar las condiciones de la transferencia embrionaria.
El contexto es el siguiente: si las propiedades mecánicas del entorno y el patrón de fuerzas embrionarias se asocian con el éxito de la implantación, en la FIV es posible seleccionar deliberadamente la rigidez/composición de la matriz, tener en cuenta las ventanas temporales de la transferencia e incluso utilizar métricas de fuerza como marcador de selección adicional. Paralelamente, estas plataformas ayudarán a explicar la proporción de pérdidas prenatales tempranas, cuando la bioquímica es normal, pero la mecánica de adhesión no lo es. Todo esto convierte las observaciones 3D directas de la implantación humana no solo en un vídeo atractivo, sino en una nueva herramienta para la medicina reproductiva.
¿Por qué es esto importante?
El fallo de implantación es una de las principales causas de infertilidad y representa hasta el 60% de los abortos espontáneos. A pesar de los avances bioquímicos en la FIV, la mecánica de este proceso en humanos seguía siendo un misterio. Un nuevo enfoque permite comprender las fuerzas y trayectorias de la implantación embrionaria y sienta las bases para mejorar la selección y las condiciones de transferencia embrionaria.
Cómo se hizo
Los investigadores ensamblaron un "útero artificial": un entorno blando, transparente y deformable en el que una matriz similar a un tejido se desplaza visiblemente bajo la influencia de fuerzas embrionarias. A continuación, se realizó microscopía continua y análisis computacional de los desplazamientos de las fibras.
- Plataformas 2D y 3D: en 3D, el embrión se inserta inmediatamente en la matriz (se “omite” la fase de fijación), lo que permite ver la perforación en el espesor del tejido.
- Alta "supervivencia y penetración" en 3D: alrededor del 80% de invasión exitosa (limitada por la proximidad al vidrio).
- Los mapas de tracción y la correlación del volumen digital muestran las amplitudes y direcciones de los desplazamientos alrededor del embrión: esencialmente una "huella" de la fuerza a lo largo del tiempo.
¿Qué fue lo que se encontró exactamente (brevemente y punto por punto)?
1) Mecánica de implantación específica de cada especie
- Humano: el embrión se inserta en la matriz, creando múltiples focos de tracción y formando desplazamientos radialmente uniformes alrededor de sí mismo; la profundidad de invasión es de hasta 200 µm.
- Ratón: el embrión se extiende principalmente sobre la superficie con direcciones de desplazamiento principales pronunciadas.
2) El embrión percibe la mecánica del entorno.
- Fuerzas externas → respuesta: en el embrión humano - reclutamiento de miosina y pseudópodos celulares dirigidos; en el ratón - rotación del eje de implantación/crecimiento hacia la fuente de fuerza externa (orientación del eje PD).
- Marcadores mecanosensibles: en ratones, cambios en la localización de YAP en el trofoblasto; en conjunto, esto indica un circuito de retroalimentación mecanosensible.
3) La relación entre la fuerza y el éxito de la implantación.
- Menor desplazamiento de colágeno → peor progreso de implantación en embriones humanos.
- Integrinas: el “acoplador” de la fuerza: el bloqueo del péptido RGD/inhibición de Src en ratones reduce la profundidad/área de implantación.
¿Cómo se ve la implementación?
- En las plataformas 2D y 3D, se forma un “halo” creciente de desplazamientos de fibras alrededor del embrión; el mapa de tracción pulsa como si el embrión estuviera “escaneando” su entorno.
- Sobre el vidrio, el embrión humano forma una masa plana, pero en una matriz blanda permanece más esférico y llega más profundo, como en el tejido vivo.
¿Qué aporta esto a la práctica (perspectivas para la FIV y no sólo)?
La idea es simple: la implantación no se limita a la química del receptor, sino también a la mecánica de adhesión y tracción. Esto significa que podemos optimizar:
- Materiales y dureza del medio durante pruebas de potencial de cultivo/implantación;
- Nuevos marcadores para la selección de embriones - basados en trayectorias y amplitud de desplazamientos en la matriz “inteligente”;
- Entrenamiento/modulación uterina (por ejemplo, a través de señales mecánicas suaves) para mejorar la adhesión sin intervenciones agresivas.
Precaución: el trabajo ex vivo no se realiza "dentro del útero". Sin embargo, el hecho mismo de que una señal mecánica externa modifique la orientación de la implantación/organización de los ejes abre la puerta a condiciones personalizadas de transferencia embrionaria.
Restricciones
- El modelo ex vivo no tiene en cuenta la dinámica inmune, hormonal y vascular del endometrio real;
- Matrigel/colágeno define un conjunto de propiedades (rigidez, viscoelasticidad, composición), es difícil cambiarlas mediante un parámetro;
- Las restricciones éticas para los estudios en humanos (hasta 14 días de ventana) limitan la observación a largo plazo. Sin embargo, la alta concordancia con los modos de implantación in vivo conocidos (intersticial en humanos vs. superficial en ratones) aumenta la confianza en el modelo.
Conclusión
El embrión humano se introduce activamente en el tejido materno, y las señales mecánicas del entorno pueden reconfigurar su comportamiento. El patrón de fuerzas y la estrategia de implantación son diferentes en humanos y ratones, lo que podría explicar por qué el modelo murino no siempre predice una implantación exitosa en humanos. La mecánica ocupa ahora un lugar destacado en la embriología temprana y la medicina reproductiva.
Fuente: Godeau AL et al. La fuerza de tracción y la mecanosensibilidad median los patrones de implantación específicos de cada especie en embriones humanos y de ratón. Science Advances 11(33): eadr5199 (15 de agosto de 2025). DOI: 10.1126/sciadv.adr519
