
Todo el contenido de iLive se revisa médicamente o se verifica para asegurar la mayor precisión posible.
Tenemos pautas de abastecimiento estrictas y solo estamos vinculados a sitios de medios acreditados, instituciones de investigación académica y, siempre que sea posible, estudios con revisión médica. Tenga en cuenta que los números entre paréntesis ([1], [2], etc.) son enlaces a estos estudios en los que se puede hacer clic.
Si considera que alguno de nuestros contenidos es incorrecto, está desactualizado o es cuestionable, selecciónelo y presione Ctrl + Intro.
Síndrome de Goodpasture: causas, síntomas, diagnóstico, tratamiento
Médico experto del artículo.
Último revisado: 04.07.2025
El síndrome de Goodpasture es un síndrome autoinmune que cursa con hemorragia pulmonar alveolar y glomerulonefritis, causada por anticuerpos anti-MBG circulantes. El síndrome de Goodpasture se presenta con mayor frecuencia en personas con predisposición genética que fuman cigarrillos, pero la inhalación de hidrocarburos y las infecciones virales de las vías respiratorias son posibles factores adicionales. Los síntomas del síndrome de Goodpasture incluyen disnea, tos, fatiga, hemoptisis y/o hematuria. Se sospecha el síndrome de Goodpasture en pacientes con hemoptisis o hematuria y se confirma por la presencia de anticuerpos anti-MBG en sangre. El tratamiento del síndrome de Goodpasture incluye plasmaféresis, glucocorticoides e inmunosupresores como la ciclofosfamida. El pronóstico es favorable si el tratamiento se inicia antes de que se desarrolle insuficiencia respiratoria o renal.
El síndrome de Goodpasture fue descrito por primera vez por él en 1919. Es una combinación de glomerulonefritis y hemorragia alveolar en presencia de anticuerpos anti-MBG. Se presenta con mayor frecuencia como una combinación de hemorragia alveolar difusa y glomerulonefritis, pero en ocasiones causa glomerulonefritis aislada (10-20%) o afectación pulmonar (10%). Afecta con mayor frecuencia a los hombres que a las mujeres.
¿Qué causa el síndrome de Goodpasture?
La causa de la enfermedad no se ha determinado con precisión. Se asume una predisposición genética al síndrome de Goodpasture, y se considera que su marcador es la presencia de HLA-DRW2. Existe una perspectiva sobre el posible papel de una infección viral previa (virus de la hepatitis A y otras enfermedades virales), riesgos industriales y medicamentos (principalmente D-penicilamina).
La patogénesis del síndrome de Goodpasture se basa en la formación de autoanticuerpos contra las membranas basales de los capilares glomerulares renales y alveolares. Estos anticuerpos, pertenecientes a la clase IgG, se unen a los anticuerpos de las membranas basales en presencia del componente C3 del complemento, lo que conlleva el desarrollo de una inflamación inmunitaria de los riñones y los alvéolos pulmonares.
Los anticuerpos anti-MBG se dirigen contra el dominio no colagenoso (NC-1) de la tercera cadena del colágeno tipo IV, que se encuentra en mayor concentración en las membranas basales de los capilares renales y pulmonares. La exposición a factores ambientales (tabaquismo, infecciones respiratorias agudas virales e inhalación de suspensiones de hidrocarbonatos, con mayor frecuencia) y, con menor frecuencia, a la neumonía, activa la presentación de antígenos capilares alveolares a los anticuerpos circulantes en personas con predisposición hereditaria (con mayor frecuencia, portadores de los alelos HLA-DRwl5, -DR4 y -DRB1). Los anticuerpos anti-MBG circulantes se unen a las membranas basales, fijan el complemento e inducen una respuesta inflamatoria celular, lo que conduce al desarrollo de glomerulonefritis o capilaritis pulmonar.
Probablemente exista cierta similitud entre los autoantígenos de la membrana basal de los capilares glomerulares renales y alvéolos. El autoantígeno se forma bajo la influencia del efecto dañino del factor etiológico. Un factor etiológico desconocido daña y modifica la estructura de las membranas basales renales y pulmonares. La excreción de los productos de degradación resultantes de las membranas basales glomerulares renales se ralentiza y disminuye cuando se dañan, lo que crea las condiciones para el desarrollo de daño autoinmune renal y pulmonar. Aún no se conoce con certeza qué componente de la membrana basal se convierte en el autoantígeno. Actualmente, se asume que se trata del componente estructural interno de la membrana basal glomerular renal, la cadena α3 del colágeno tipo 4.
Los complejos inmunitarios formados se depositan a lo largo de las membranas basales de los capilares glomerulares, lo que conduce al desarrollo de un proceso inflamatorio inmunitario en el glomérulo renal (glomerulonefritis) y los alvéolos (alveolitis). Las principales células implicadas en el desarrollo de esta inflamación inmunitaria son los linfocitos T, monocitos, endoteliocitos, leucocitos polimorfonucleares y macrófagos alveolares. La interacción entre ellos se proporciona mediante mediadores moleculares, citocinas (factores de crecimiento plaquetario, similares a la insulina, β-transformadores; interleucina-1, factor de necrosis tumoral, etc.). Los metabolitos del ácido araquidónico, los radicales libres de oxígeno, las enzimas proteolíticas y las moléculas adhesivas desempeñan un papel fundamental en el desarrollo de la inflamación inmunitaria.
La activación de los macrófagos alveolares es fundamental para el desarrollo de la alveolitis en el síndrome de Goodpasture. En estado activado, secretan alrededor de 40 citocinas. Las citocinas del grupo I (quimiotaxinas, leucotrienos, interleucina-8) favorecen el flujo de leucocitos polimorfonucleares hacia los pulmones. Las citocinas del grupo II (factores de crecimiento plaquetario y macrófago) promueven el movimiento de fibroblastos hacia los pulmones. Los macrófagos alveolares también producen formas activas de oxígeno, las proteasas, que dañan el tejido pulmonar.
Patomorfología del síndrome de Goodpasture
Las principales manifestaciones patomorfológicas del síndrome de Goodpasture son:
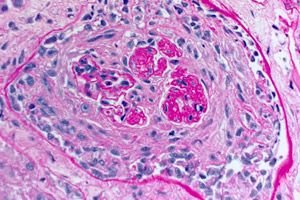
- Daño predominante en el lecho microcirculatorio de los riñones y pulmones. En los pulmones, se observa un cuadro de venulitis, arteriolitis y capilaritis con fenómenos pronunciados de destrucción y proliferación; el daño capilar se observa principalmente en los tabiques interalveolares, y se desarrolla alveolitis con exudado hemorrágico en los alvéolos. El daño renal se caracteriza por el desarrollo de glomerulonefritis proliferativa extracapilar con la consiguiente formación de hialinosis y fibrosis, lo que conduce al desarrollo de insuficiencia renal.
- hemorragias intraalveolares pronunciadas;
- desarrollo de hemosiderosis pulmonar y neumosclerosis de diversos grados de gravedad, como resultado de la evolución de la alveolitis.
Síntomas del síndrome de Goodpasture
La enfermedad se presenta con mayor frecuencia con manifestaciones clínicas de patología pulmonar. La hemoptisis es el síntoma más prominente; sin embargo, la hemoptisis puede estar ausente en presencia de manifestaciones hemorrágicas, y el paciente puede presentar únicamente cambios infiltrativos en la radiografía de tórax o un infiltrado y dificultad o insuficiencia respiratoria. Son frecuentes la disnea (principalmente con el esfuerzo), la tos, el malestar general, la disminución de la capacidad laboral, el dolor torácico, la fiebre y la pérdida de peso. Hasta el 40 % de los pacientes presenta macrohematuria, aunque la hemorragia pulmonar puede preceder a las manifestaciones renales entre semanas y años.
Durante la hemoptisis, la dificultad para respirar puede aumentar. La debilidad y la disminución de la capacidad laboral también son motivo de preocupación.
Los síntomas del síndrome de Goodpasture varían con el tiempo, desde pulmones limpios a la auscultación hasta estertores crepitantes y secos. Algunos pacientes presentan edema periférico y palidez debido a la anemia.
Durante el examen, se observa palidez, cianosis de las mucosas, pastosidad o hinchazón pronunciada de la cara, disminución de la fuerza muscular y pérdida de peso. La temperatura corporal suele estar elevada hasta niveles febriles.
Al percutir los pulmones se puede detectar un acortamiento del sonido de percusión en focos extensos de hemorragia pulmonar, pero esto se observa raramente; más a menudo no hay cambios en el sonido de percusión.
Un signo auscultatorio característico del síndrome de Goodpasture son las sibilancias secas y húmedas, cuyo número aumenta significativamente durante o después de la hemoptisis.
Al examinar el sistema cardiovascular, se observa hipertensión arterial, posiblemente un aumento del borde de matidez cardíaca relativa hacia la izquierda, ruidos cardíacos apagados, un soplo sistólico suave y un soplo de fricción pericárdica, con el desarrollo de insuficiencia renal grave. Con daño renal progresivo en el contexto de hipertensión arterial significativa, puede desarrollarse insuficiencia ventricular izquierda aguda con un cuadro de asma cardíaca y edema pulmonar. Generalmente, esta situación se presenta en la fase terminal de la enfermedad.
Por lo general, el daño renal se manifiesta más tarde, transcurrido cierto tiempo desde la aparición de los síntomas pulmonares. Los signos clínicos característicos de la patología renal son hematuria (en ocasiones, macrohematuria), insuficiencia renal de rápida progresión, oliguria e hipertensión arterial.
En el 10-15% de los casos, el síndrome de Goodpasture comienza con signos clínicos de patología renal: aparece el cuadro clínico de glomerulonefritis (oliguria, edema, hipertensión arterial, palidez pronunciada) y luego se unen los síntomas de daño pulmonar. Muchos pacientes pueden presentar mialgia, artralgia.
Independientemente de las variantes de inicio, el síndrome de Goodpasture suele ser grave, la enfermedad progresa de forma constante y se desarrolla insuficiencia pulmonar y renal grave. La esperanza de vida de los pacientes desde el inicio de la enfermedad varía de varios meses a uno a tres años. Con mayor frecuencia, los pacientes fallecen por uremia o hemorragia pulmonar.
¿Qué te molesta?
Diagnóstico del síndrome de Goodpasture
El diagnóstico del síndrome de Goodpasture requiere la detección de anticuerpos séricos anti-MBG mediante inmunofluorescencia indirecta o, cuando esté disponible, mediante ensayo inmunoabsorbente ligado a enzimas (ELISA) directo con NC-1 a3 humano recombinante. Otras pruebas serológicas, como las pruebas de anticuerpos antinucleares (ANA), se utilizan para detectar LES y el título de antiestreptolisina-O para detectar glomerulonefritis posestreptocócica, que puede ser la causa de muchos casos de síndrome pulmonar-renal. Los ANCA son positivos (en muestras periféricas) en el 25% de los casos de síndrome de Goodpasture. Puede estar indicada una biopsia renal si hay glomerulonefritis (hematuria, proteinuria, lodo rojo en el análisis de orina o insuficiencia renal). La glomerulonefritis necrosante focal y segmentaria de progresión rápida con un curso progresivo se encuentra en la biopsia en el síndrome de Goodpasture y todas las demás causas de síndrome pulmonar-renal. La tinción de inmunofluorescencia del tejido renal o pulmonar revela clásicamente un depósito lineal de IgG a lo largo de los capilares glomerulares o alveolares. También se observa en el riñón diabético y la glomerulonefritis fibrilar, un trastorno poco frecuente que causa síndrome pulmonar-renal, pero la detección de anticuerpos contra el GBM en estos trastornos es inespecífica.
Las pruebas de función pulmonar y el lavado broncoalveolar no diagnostican el síndrome de Goodpasture, pero pueden utilizarse para confirmar la presencia de hemorragia alveolar difusa en pacientes con glomerulonefritis e infiltrados pulmonares, pero sin hemoptisis. El líquido de lavado que persiste hemorrágico después de múltiples lavados puede confirmar el síndrome hemorrágico difuso, especialmente si se acompaña de una disminución del hematocrito.
 [ 3 ]
[ 3 ]
Diagnóstico de laboratorio del síndrome de Goodpasture
- Análisis de sangre general. Los signos característicos son anemia hipocrómica por deficiencia de hierro, hipocromía, anisocitosis y poiquilocitosis eritrocitaria. También se observa leucocitosis, desviación a la izquierda de la fórmula leucocitaria y un aumento significativo de la VSG.
- Análisis general de orina. Se encuentran proteínas (el grado de proteinuria puede ser significativo), cilindros (granulares, hialinos, eritrocitarios) y eritrocitos (puede presentarse macrohematuria). A medida que la insuficiencia renal crónica progresa, la densidad relativa de la orina disminuye y se desarrolla isohipostenuria en la prueba de Zimnitsky.
- Análisis bioquímico de sangre. Aumento de los niveles sanguíneos de urea, creatinina, haptoglobina, seromucoide, a2 y gammaglobulinas, y disminución del contenido de hierro.
- Estudios inmunológicos. Se puede detectar una disminución del número de linfocitos T supresores y se detectan inmunocomplejos circulantes. Los anticuerpos contra la membrana basal de los capilares glomerulares y alveolares se detectan mediante inmunofluorescencia indirecta o métodos radioinmunológicos.
- Análisis de esputo. El esputo contiene numerosos eritrocitos, hemosiderina y se detectan siderófagos.
Diagnóstico instrumental del síndrome de Goodpasture
- Examen radiográfico de los pulmones. Los signos radiográficos característicos son infiltrados pulmonares en la región radicular que se extienden a las porciones inferior y media de los pulmones, así como infiltrados progresivos, simétricos y bilaterales de aspecto nuboso.
- Estudio de la función de la respiración externa. La espirometría revela una insuficiencia respiratoria restrictiva (disminución de la capacidad vital); a medida que la enfermedad progresa, se presenta una insuficiencia respiratoria obstructiva (disminución del FEV1 y del índice de Tiffeneau).
- ECG. Se revelan signos de distrofia miocárdica grave de origen anémico e hipóxico (reducción de la amplitud de las ondas T y del intervalo ST en muchas derivaciones, con mayor frecuencia en las del tórax izquierdo). En caso de hipertensión arterial grave, aparecen signos de hipertrofia miocárdica del ventrículo izquierdo.
- El análisis de gases en sangre revela hipoxemia arterial.
- Análisis de biopsias de pulmón y riñón. Se realiza una biopsia de tejido pulmonar (biopsia abierta) y de riñón para confirmar el diagnóstico si no es posible diagnosticar la enfermedad con precisión mediante métodos no invasivos. Se realiza un análisis histológico e inmunológico de las biopsias. Los siguientes signos son característicos del síndrome de Goodpasture:
- la presencia de signos morfológicos de glomerulonefritis (más a menudo extracapilar), alveolitis hemorrágica, hemosiderosis y fibrosis intersticial;
- Detección de depósitos lineales de IgG y del componente C3 del complemento en las membranas basales de los alvéolos pulmonares y glomérulos renales mediante el método de inmunofluorescencia.
Criterios diagnósticos del síndrome de Goodpasture
Al realizar el diagnóstico del síndrome de Goodpasture, es aconsejable utilizar los siguientes criterios.
- Una combinación de patología pulmonar y patología renal, es decir, hemoptisis (a menudo hemorragia pulmonar), dificultad para respirar y síntomas de glomerulonefritis.
- Curso progresivo constante de la enfermedad con desarrollo de insuficiencia respiratoria y renal.
- Desarrollo de anemia por deficiencia de hierro.
- Detección durante el examen radiográfico de los pulmones de múltiples infiltrados bilaterales de tipo nuboso en el contexto de una deformación reticular del patrón pulmonar.
- Detección en sangre de altos títulos de anticuerpos circulantes contra la membrana basal de los glomérulos y alvéolos renales.
- Detección de depósitos lineales de IgG y componente del complemento C3 en las membranas basales de los capilares glomerulares y alveolares.
- Ausencia de otras manifestaciones sistémicas (excepto pulmonares y renales).
Diagnóstico diferencial del síndrome de Goodpasture
El síndrome de Goodpasture debe diferenciarse de diversas enfermedades que se manifiestan por hemoptisis o hemorragia pulmonar. Es necesario descartar enfermedades oncológicas de los bronquios y pulmones, tuberculosis, abscesos pulmonares, bronquiectasias, enfermedades cardíacas y vasculares (que causan congestión e hipertensión en la circulación pulmonar), vasculitis sistémica y diátesis hemorrágica.
Programa de detección del síndrome de Goodpasture
- Análisis generales de sangre y orina.
- Análisis bioquímico de sangre: determinación de proteínas totales y fracciones proteicas, creatinina y urea, transaminasas, seromucoide, haptoglobina, fibrina, hierro.
- Análisis de esputo: examen citológico, determinación de siderófagos.
- Estudios inmunológicos: determinación del contenido de linfocitos B y T, subpoblaciones de linfocitos T, inmunoglobulinas, complejos inmunes circulantes, anticuerpos contra las membranas basales de los glomérulos de los riñones y alvéolos.
- Examen de rayos X de los pulmones.
- ECG.
- Espirometría.
- Examen de biopsias de pulmón y riñón.
¿Qué pruebas son necesarias?
Tratamiento del síndrome de Goodpasture
El tratamiento del síndrome de Goodpasture incluye plasmaféresis diaria o en días alternos durante 2 a 3 semanas (plasmaféresis de 4 L) para eliminar los anticuerpos anti-MBG, combinado con glucocorticoides intravenosos (generalmente metilprednisolona 1 g durante al menos 20 minutos en días alternos 3 veces con prednisolona 1 mg/kg de peso corporal al día) y ciclofosfamida (2 mg/kg una vez al día) durante 6 a 12 meses para prevenir la formación de nuevos anticuerpos. La terapia puede reducirse gradualmente cuando la función pulmonar y renal deje de mejorar. La mortalidad a largo plazo está relacionada con el grado de deterioro renal al inicio de la enfermedad; los pacientes que requieren diálisis temprana y aquellos con más del 50% de nefronas en semilunas en la biopsia tienen tiempos de supervivencia de menos de 2 años y a menudo requieren diálisis a menos que se considere el trasplante renal. La hemoptisis puede ser un buen signo de pronóstico porque conduce a la detección temprana de la enfermedad; la minoría de los pacientes que son ANCA positivos responden mejor al tratamiento para el síndrome de Goodpasture. La recurrencia ocurre en un pequeño porcentaje de casos y se asocia con el tabaquismo continuo y las infecciones de las vías respiratorias. En pacientes con enfermedad renal terminal que se han sometido a un trasplante de riñón, la enfermedad puede reaparecer en el injerto.
¿Cuál es el pronóstico del síndrome de Goodpasture?
El síndrome de Goodpasture suele progresar rápidamente y puede ser mortal a menos que se diagnostique y se trate rápidamente; el pronóstico es bueno cuando el tratamiento se inicia antes de que se desarrolle una insuficiencia respiratoria o renal.
La supervivencia inmediata en el momento de una hemorragia pulmonar y una insuficiencia respiratoria está asociada con asegurar la permeabilidad de las vías respiratorias; se recomienda la intubación endotraqueal y la ventilación mecánica en pacientes con niveles limítrofes de gases en sangre arterial e insuficiencia respiratoria inminente.

